Химия и химические технологии/6. Органическая химия
К.х.н.
Мамырбекова А.К.
Южно-Казахстанский
государственный университет им. М. Ауэзова,
Казахстан
Электроосаждение меди из неводных растворов
Органические диполярные растворители,
характеризующиеся высоким донорным
числом – диметилсульфоксид (ДМСО) (ДN 29,8) и
Ру (ДN 33,1) – обладают способностью к образованию
комплексов с некоторыми ds-металлами [1]
и высокой адсорбируемостью на металлах [2]. Молекулы (CH3)2SO, как катионотропные, образуют довольно прочные
комплексы с ионами меди(II). Известны
также устойчивые в водной среде комплексы [(CH3)2SONO3]- [3].
Молекулы C5H5N, благодаря наличию несвязанной пары электронов у атома
азота, в кислой среде легко
протонируются, образуя ион пиридиния HРу+,
как в адсорбированном, так и в неадсорбированном состояниях. Пиридиний в
растворах солей меди образует устойчивые
комплексные ионы CuPy+n и CuPy2+n,
где n – целое
число в интервале от 1 до 4 [4]. Термодинамический анализ Е-рН диаграммы
системы Cu-Py-H2O [5] показывает,
что присутствие молекул гетероароматического соединения в системе обусловливает
расширение области рН стабильности электролита.
Анализ электронной структуры молекул (CH3)2SO и особенностей металлической решетки меди [6]
позволяет сделать заключение о наиболее
вероятной ориентации адсорбированных
молекул ДМСО атомом кислорода к металлу. Катионы НРу+ адсорбируются на электроде
плоскостью ароматического кольца [7].
Нами изучено электроосаждение меди из
растворов нитрата меди в ДМСО и ацетилацетоната
меди в смеси пиридина с уксусной кислотой. Выбор солей меди определялся их
растворимостью в указанных растворителях.
Установлено, что при электролизе растворов
ацетилацетоната меди(II) в смеси Ру с
уксусной кислотой, благодаря адсорбции на поверхности катода молекул C5H5N и аддуктов,
образуемых солью меди с ионами пиридиния, на электроде выделяется слой
электролитической меди с заметно
модифицированными кристаллитами.
Для выделения меди из
диметилсульфоксидного раствора нами изучены растворимость нитрата меди(II) в ДМСО и физико-химические свойства получаемых
растворов, и на этой основе разработан электролит меднения. Установлена хорошая
растворимость кристаллогидрата нитрата меди Cu(NO3)2.3H2O в ДМСО. Содержание воды в смесях с ДМСО в молярных соотношениях,
не превышающих величин порядка 1:9, незначительно влияет на физико-химические
свойства органического растворителя.
При изучении электропроводности
растворов тригидрата нитрата меди в
ДМСО установлено, что в разбавленных растворах (0,01-0,2 М) содержание воды
в которых составляет 0,23-4,13 моль. %, нитрат меди ионизирован практически нацело: степень диссоциации в
интервале температур 15-45оС составляет 0,80-0,94. С увеличением
концентрации раствора степень диссоциации снижается, особенно резко при
концентрациях выше 0,35 М. Резкое падение степени диссоциации и снижение проводимости электролита объясняются,
очевидно, ионной ассоциацией, усиливающейся с ростом концентрации раствора.
Следует отметить еще одну особенность рассматриваемых электролитов. По мере
увеличения содержания воды, вносимой в составе кристаллогидрата, молекулы воды
связываются непосредственно с молекулами (CH3)2SO водородной связью, достаточно прочной при температурах
ниже 30оС. Образование гетеромолекулярных ассоциатов, ослабляя
сольватацию ионов и повышая вязкость раствора, благоприятствует ассоциации
ионов, снижению проводимости раствора.
Вольтамперные кривые при всех
условиях выделения меди представляют
графики с двумя пиками, что
свидетельствует о двухстадийном восстановлении меди. Среднее значение гетерогенной константы скорости, рассчитанное
по уравнению Матсуды [8] при 24оС
для первой стадии равно 2,38.10-3 см.с-1.
Для второй ступени эта величина на порядок ниже. Малые значения гетерогенных
констант скоростей и коэффициентов переноса электронов (a1 = 0,28; a2 =0,21)
являются следствием квазиобратимого восстановления меди из органического
раствора на катоде. Если первая ступень процесса контролируется преимущественно переносом заряда, то вторая, скорее всего, - стадией доставки
электроактивных частиц к катоду или десольватации, что требует уточнения.
Относительный температурный коэффициент
восстановления меди в пределах температур 24-35 оС составляет
0,05844 К-1, что подтверждает
преимущественно электрохимический характер контроля катодного процесса.
При более высоких температурах скорость
восстановления меди падает вследствие возникновения и усиления скоростей
побочных процессов, наиболее вероятный из которых – восстановление
нитрат-ионов.
Результаты исследования кинетических
закономерностей, а также микроструктуры
и морфологии и выхода по току электролитических осадков меди, получаемых
из электролитов различной концентрации
при различных плотностях тока и
температурах, подтверждают следующую гипотезу о схеме катодных процессов
при электролизе диметилсульфоксидных растворов нитрата меди(II).
При электролизе раствора трехводного
нитрата меди в ДМСО на катоде возможно
протекание двух основных процессов:
ступенчатое восстановление
ионов меди
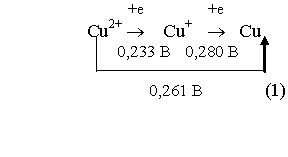
![]()
![]() восстановление
нитрат-ионов
восстановление
нитрат-ионов
NO3- + H2O +2e = NO2- + 2OH- (2)
Стандартный потенциал ![]()
![]() известен лишь для
водных растворов. Если даже предположить более отрицательное значение
известен лишь для
водных растворов. Если даже предположить более отрицательное значение ![]() в органической среде
благодаря сольватации NO3- – ионов,
на катоде преимущественно протекает процесс (1). Катодное восстановление нитрат-ионов становится
возможным лишь в условиях значительных
затруднений процесса (1), более вероятных в разбавленных растворах.
в органической среде
благодаря сольватации NO3- – ионов,
на катоде преимущественно протекает процесс (1). Катодное восстановление нитрат-ионов становится
возможным лишь в условиях значительных
затруднений процесса (1), более вероятных в разбавленных растворах.
Влияние молекул растворителя ДМСО
связано, как и в случае электроосаждения
меди из ацетатно-пиридиновых растворов, вероятнее всего, с образованием ионами
меди и анионами соли прочных сольватов,
а также с адсорбцией молекул (CH3)2SO на межфазной границе электрод/электролит. Наиболее полно эти функции растворителя реализуются в
разбавленных по ионам металла растворах
при низких температурах и невысоких катодных поляризациях. При этом на катоде
осаждается гладкое, розового цвета покрытие.
Повышение температуры и высокая
поляризация катода обусловливают ослабление влияния ДМСО на восстановление
меди. Рост температуры благоприятствует процессу (2) и, кроме того,
благоприятствует окислению (CH3)2SO нитрат-ионами, что особенно заметно в
концентрированных растворах. Из 0,4 М растворов Cu(NO3)2.3Н2О
в ДМСО при температурах 20-25 оС качественные
гальванопокрытия медью осаждаются при катодных плотностях тока 0,7-0,9 А.дм-2.
Таким образом, предложен новый электролит
меднения, представляющий раствор Cu(NO3)2.3Н2О
в ДМСО. Варьируя концентрацию электролита в пределах 0,1-0,4 М и катодную плотность
тока 0,01-1,0 А.дм-2,
при температурах 20-25оС можно получить электролитические осадки меди, различающиеся микроструктурой и
морфологией.
Литература:
1. Общая органическая химия. Т.8.
Азотсодержащие гетероциклы/ Под ред. Бартона Д. и Оллиса У.Д. –М.:Химия, 1985.
752 с.
2. Пейн Р. Электрохимия металлов в
неводных растворах. М.: Мир, 1974. С.82.
3. Martin
D., Haupthal H. Dimethylsulfoxid. Berlin: Academie – Verlag, 1981. 494 p.
4. Лурье Ю.Ю. Справочник по аналитической
химии. М.: Химия, 2000. С.324.
5.
Вахидов Р.М., Мамырбекова А.К. Электроосаждение меди из неводных растворов//Тез.
докл. VI Международной конф. «Проблемы сольватации и комплексообразования в растворах». Иваново. 1995. C. 155.
6. Барановский В.И., Кукушкин Ю.Н., Панина
Н.С. Журнал неорганической химии. 1973. Т.18. С.1602.
7. Дамаскин Б.Б., Сурвила А.А., Васина
С.Я. Электрохимия. 1987. Т.3. С.825.
8.
Будников Г.К. Принципы и применение вольтамперной осциллографической полярографии.
Казань: Изд. Казан. ун-та, 1975. 197 с.