Химия и химические технологии (5)
*Бондарев Н.В., **Зайцева
И.С.
*Национальный университет им. В.Н.
Каразина, Харьков
**Харьковская национальная академия
городского хозяйства
ТЕРМОДИНАМИКА ХИМИЧЕСКИХ
РАВНОВЕСИЙ
И МОДЕЛИРОВАНИЕ
ВЫХОДА ПРОДУКТА РЕАКЦИИ
Количественная теория химических равновесий в
растворах предполагает получение, обобщение и унификацию экспериментальных
данных по термодинамике равновесий и сольватации (пересольватации) реагентов в
стандартном состоянии и разработку методов определения (оценки) энергетических
параметров межчастичных взаимодействий в реальных (концентрированных) растворах.
Превращение
исходных веществ в продукты реакции с заданными свойствами зависит от свойств
реагентов и растворителя, в котором протекает реакция. Поэтому актуальной задачей термодинамической
теории химических равновесий является прогнозирование и моделирование выхода
продукта реакции на основе термодинамических свойств реагентов – энергетических
характеристик сольватации (пересольватации).
В общем случае взаимосвязь
между энергией Гиббса (![]() ) химического превращения
) химического превращения
nAA
+ nBB Û
nСC
+ nDD
в разных растворителях, энергией
Гиббса пересольватации (![]() ), коэффициентами активности (gi) и текущими моляльными
концентрациями (mi) реагентов
имеет вид [1]
), коэффициентами активности (gi) и текущими моляльными
концентрациями (mi) реагентов
имеет вид [1]
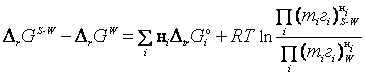 ,
,
где
![]() ;
; ![]() и
и ![]() – изменение
энергии Гиббса (химическое сродство) и стандартной энергии Гиббса (стандартное
химическое сродство) химического превращения в воде (W) и водно-органическом растворителе (S-W).
– изменение
энергии Гиббса (химическое сродство) и стандартной энергии Гиббса (стандартное
химическое сродство) химического превращения в воде (W) и водно-органическом растворителе (S-W).
Рассматриваются
методологические вопросы моделирования выхода коронатов натрия и калия в
водно-органических растворителях на основе уравнения взаимосвязи концентрационной
константы ![]() образования комплексов
1:1 MLCl (выхода коронатов) с соответствующими
термодинамическими параметрами переноса
образования комплексов
1:1 MLCl (выхода коронатов) с соответствующими
термодинамическими параметрами переноса ![]() МCl, 18-краун-6 и MLCl из воды в
водно-органические растворители, равновесными концентрациями реагентов [і] и первичными солевыми
эффектами
МCl, 18-краун-6 и MLCl из воды в
водно-органические растворители, равновесными концентрациями реагентов [і] и первичными солевыми
эффектами ![]()
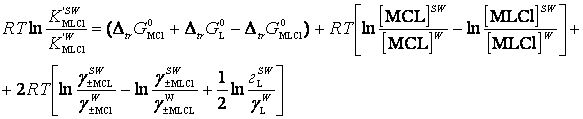
![]() Показано,
что возрастание выхода продукта реакции (коронатов) с ростом содержания
неводного компонента в смешанных водно-органических растворитлях обусловлено преимущественно
первичными эффектами среды.
Показано,
что возрастание выхода продукта реакции (коронатов) с ростом содержания
неводного компонента в смешанных водно-органических растворитлях обусловлено преимущественно
первичными эффектами среды.
Рассматривается
обобщенная сольватационно-термодинамическая модель равновесий в растворах [2],
согласно которой стандартное химическое
сродство (![]() ) зависит от свойств растворителя (стандартных термодинамических
параметров пересольватации реагентов):
) зависит от свойств растворителя (стандартных термодинамических
параметров пересольватации реагентов):
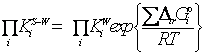 ,
,
где термодинамические константы химических
равновесий, выраженные в различных концентрационных шкалах, связаны
соотношением 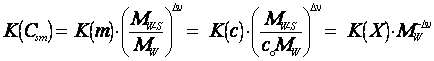
из которого следует, что константа
равновесия не зависит от выбора единиц измерения концентраций, когда
стехиометрический состав исходных веществ и продуктов реакции остается неизменным
[3].
Показано: а) для сопоставительного
анализа стандартных термодинамических характеристик химических равновесий в
различных растворителях необходимо использовать сольвомоляльную
концентрационную шкалу; б) сравнительному анализу влияния термодинамических
характеристик пересольватации реагентов на смещение химического равновесия (![]() ) в растворителях различной природы отвечает нормировка
стандартного состояния для реагентов в мольно-долевой либо сольвомоляльной шкале.
) в растворителях различной природы отвечает нормировка
стандартного состояния для реагентов в мольно-долевой либо сольвомоляльной шкале.
Приведены примеры
унифицированного сопоставительного анализа эффектов водно-органических
растворителей в координации катионов натрия, калия, аммония и серебра (M) с
эфиром 18-краун-6 (L): M + L
= LM в стандартном состоянии на основе уравнения
![]()
и предложенной в [2] сольватационно-термодинамической
классификации устойчивости коронатов.
Рассматриваются
термодинамические аспекты влияния первичных эффектов среды, концентрации и
ионной силы раствора на кислотно-основные равновесия красителей (HB = H+
+ B–) в мицеллярной фазе и гальвани-потенциал (![]() ) на границе раздела водный раствор – псевдофаза:
) на границе раздела водный раствор – псевдофаза:
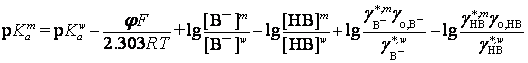 ,
,
здесь, согласно Н.А.Измайлову, ![]() – первичный эффект среды для ионов H+, B–
и недиссоциированных частиц HB;
– первичный эффект среды для ионов H+, B–
и недиссоциированных частиц HB; ![]() ,
, ![]() – концентрационные
коэффициенты активности частиц в мицеллярной и водной фазах;
– концентрационные
коэффициенты активности частиц в мицеллярной и водной фазах; ![]() – единый коэффициент активности частиц.
– единый коэффициент активности частиц.
1. Бондарев
Н.В. // Тез. докл. Междунар. конф. "Физико-химические основы
новейших технологий XXI века".
Москва, ИФХЭ. 2005. Т. 1, ч.2.
С. 245.
2. Бондарев Н.В. // Журн. общ. химии. 2006. Т. 76, № 1.
С. 13–18.
3.
Tsurko E.N., Bondarev N.V. // J. Mol. Liq. 2007. V.131-132. P. 151-157.
ЗАЯВКА НА УЧАСТИЕ В КОНФЕРЕНЦИИ
"Дни
науки – 2007"
Украина,
Днепропетровск
1-15
апреля 2007год.
1. Бондарев Н.В. –
к.х.н., доцент, доцент кафедры физической химии, Харьковский
национальный университет им. В.Н. Каразина, 61077, г . Харьков, пл. Свободы, 4, тел. (057)707-54-45, Е-mail:
bondarev_n@rambler.ru
2.
Зайцева И.С. – к.х.н., старший преподаватель, Харьковская национальная
академия городского хозяйства,