Химия и химические технологии/4.
Химико-фармацевтическое производство
Серкова
А.Н., к.х.н. Глазова Н.В.
Санкт-Петербургская
государственная химико-фармацевтическая академия, Россия
Использование наносистем в качестве перспективы создания
новых лекарственных форм
Производство ферментных препаратов
является одним из перспективных направлений современной биотехнологии.
В последнее время все большее значение
имеет нанотехнология. Широкое применение нашли нанообъекты во многих
отраслях промышленности и медицины.
Так как ферменты можно
отнести к числу нанообъектов, то одним из современных направлений
нанотехнологии является их иммобилизация с целью получения модифицированных
лекарственных средств [1]. Модифицированные
препараты обладают рядом преимуществ по сравнению с нативными
предшественниками: пролонгированным действием, регулируемой активностью,
повышенной устойчивостью к действию различных факторов. Методы модификации
открывают широкие возможности для создания лекарственных препаратов
комплексного действия путём совместной модификации ферментов, антибиотиков,
гормонов и других соединений, обладающих выраженным терапевтическим свойством.
Существуют методы физической и химической
иммобилизации.
Физические методы иммобилизации являются
более мягкими и не вызывают сильных изменений в структуре белковой молекулы.
Наибольшее
распространение среди них получили: включение в липосомы и
микрокапсулирование.
Липосомы, как наночастицы для
защиты и доставки, состоят из полого ядра (поперечно-сшитый модифицированный крахмал), ковалентно связанного
липидного слоя (сложные эфиры
жирных кислот), слоя (слоев) полярных липидов (гидрогенированный лецитин).
Основой для получения являются фосфолипиды, важнейшим представителем которых
является лецитин [2].
Наиболее перспективными сейчас
являются такие микрокапсулы, как гликосферы. Гликосфера представляет из себя
сферу, состоящую из нескольких слоев. Внутри – твердое ядро в виде поперечно
сшитого модифицированного крахмала (гидрофильный слой), средний слой представляет
собой ковалентно-связанный липидный слой (сложные эфиры жирных кислот,
гидрофобный слой).
Для исследования были выбраны:
·
протеолитический фермент
химопсин. Выбор данного гидролитического фермента, который является смесью
химотрипсина и трипсина, обусловлен тем, что его модификация представляет
большой интерес, как в медицине, так и в косметической промышленности.
Протеолитические ферменты обладают выраженным противовоспалительным и
противоотечным действием и эффективны при лечении гнойно-воспалительных
процессов различной локализации и этиологии [3].
·
гидролитический фермент
ДНК-аза. Выбор гидролитического фермента ДНК-азы обусловлен тем, что ДНК-аза
обладает выраженным противовоспалительным и противовирусным действием при
лечении гнойно-воспалительных процессов различной локализации и этиологии.
Особый интерес представляет активность ДНК-азы в отношении вирусов герпеса,
особенно в связи с тем, что эти заболевания являются следствием постгриппозного
состояния [4].
·
фермент пероксидаза. Уникальные свойства этого фермента –
хорошая растворимость в воде, высокая специфичность по окислителю, устойчивость
при хранении, широкий спектр биологической активности, обусловливают ее
применение в медицине, науке и технике [5]. В
медицине пеpоксидаза применяется для диагностики острых, хронических
бактериальных и вирусных (в том числе СПИД), инфекционных, аллергических,
аутоиммунных, эндокринологических заболеваний и злокачественных новообразований
методом иммунологического анализа. Данные по пероксидазной активности
учитывают при селекции растений (чем выше эта активность,
тем устойчивее к инфекции растения). Перспективно применение пероксидаз для
селективного окисления органических
соединений, а также для глубокой очистки сточных вод
от ароматических соединений [6].
Для модификации ферментов и дальнейшего введения их в готовые формы было необходимо подобрать оптимальные соотношения фермент: компонент, так как известно, что используемые ферменты являются лабильными веществами и могут терять активность как при создании готовой формы, так при её хранении.
Опыты ставились по следующей схеме:
– готовился раствор фермента. Концентрация энзима в полученном растворе определялась по методу Лоури и Кумасси.
– для каждого компонента взвешивались различные по массе навески, которые вносились в раствор фермента. Полученные таким образом растворы выдерживались 10–15 минут при комнатной температуре t=20–22оС при периодическом перемешивании.
– по истечении времени в растворах определялась общая активность фермента (по соответствующей методике), т.е. активность как связанного (прореагировавшего), так и свободного (оставшегося в растворенном состоянии) фермента:
Аобщ.=Асвяз.+Асвоб.
– в качестве контроля использовался раствор нативного фермента, который готовился и выдерживался при тех же самых условиях.
Экспериментальные данные по взаимодействию
ДНК-азы с нанообъектами и антисептиком (хлоргексидин, который содержится в
рассматриваемой далее готовой лекарственной форме) представлены на Рис. 1.
![]()
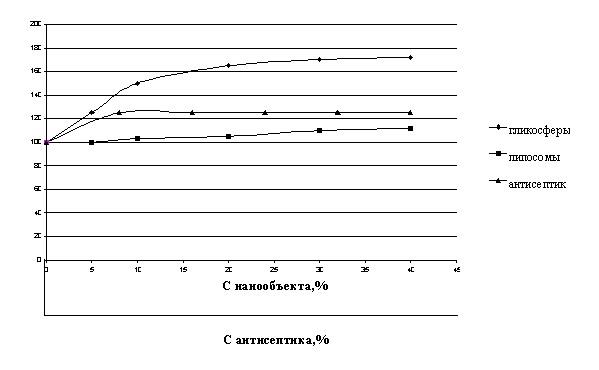

Рис. 1.Влияние нанообъектов и антисептика на
активность ДНК-азы
Как видно из графика, представленного на Рис.
1, ни один из компонентов не оказывает ингибирующего влияния на общую
активность ДНК-азы. С учетом экспериментальных данных, представленных на Рис. 1,
были подобраны оптимальные соотношения ДНК–аза: носитель, которые
рекомендовались для создания готовой формы.
Следующим этапом исследования было
выяснение возможности расчета количества фермента на носителе для изучения
стабильности фермента во времени, что необходимо при создании готовой формы.
Для этого применили метод кинетики диффузии через пористые мембраны, который
позволяет рассчитать количество свободного и связанного в комплекс с носителем
фермента. Этот метод был эффективно использован для изучения растворимых комплексов
фермент: полимер.
Представляло интерес изучить влияние
фосфолипидов (основа для получения липосом) на различные ферменты.
Как видно из Рис.2 фосфолипиды повышают
активность химопсина и кривая имеет экстремум. Наивысшая активность фермента
наблюдается при концентрации фосфолипидов равной 3 мг/мл.
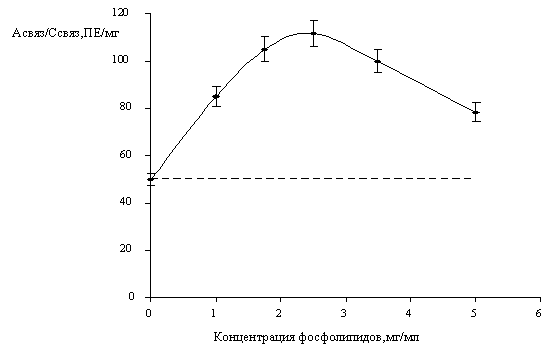

Рис.2. Влияние концентрации фосфолипидов на
активность связанного химопсина
Для
использования ферментов в виде готовых форм важно знать их стабильность при
хранении в течение срока годности. Поэтому была проведена: сравнительная оценка
сохранности активности химопсина при хранении в виде раствора фермента,
лиофильно высушенного фермента, а также в образце геля; сравнительная оценка сохранности активности ДНК-азы при хранении в
виде растворов фермента в сочетании с антисептиком и наноматериалами, а также в
полученных образцах гигиенических салфеток.
Данные по определению ферментативной
активности ДНК-азы в готовой форме за период наблюдения представлены в таблице
1.
Таблица 1
|
t, сут. |
А, ЕА/упаковка |
|
0 |
38400 |
|
31 |
34560 |
Результаты экспериментов, представленные в
таблице 1, показали, что при введении ДНК-азы в готовую форму происходит
частичная потеря ферментативной активности, что, вероятно, связано с
необратимой сорбцией салфеткой. Но при дальнейшем хранении в течение срока
наблюдения фермент не изменяет своей активности.
Ценность пероксидазы, как лекарственного
препарата, может возрастать, если использовать её в комплексе с другими
биологически активными веществами, которые значительно расширяют её спектр
действия, например, с антибиотиками. К тому же антибиотик способствует
добавлению в меньших количествах консервантов в состав лекарственной формы.
Перспективными в этом направлении считаются аминогликозидные антибиотики.
Особенно антибиотики III поколения, например,
гентамицин.
Чтобы получить данные о
возможности такого нанообъекта, необходимо первоначально выяснить как
гентамицин влияет на активность и стабильность пероксидазы.
По экспериментальным данным строилась
кривая зависимости А/Аисх = f
(антибиотик/фермент, мг/мг), которая представлена ниже на Рис. 3.
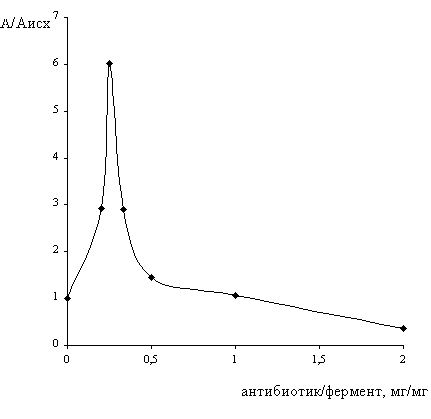

Рис. 3. Влияние антибиотика гентамицина на
активность пероксидазы
Кривая зависимости А/Аисх = f (антибиотик/фермент, мг/мг) имеет
максимум, которому соответствует оптимальное соотношение антибиотик/фермент,
при этом активность пероксидазы увеличивается в шесть раз по сравнению с
исходной. Сравнивая с изменением активности пероксидазы в течение суток в
исходном экстракте можно сказать, что при добавлении гентамицина активность
пероксидазы сохраняется на исходном уровне, а без добавления гентамицина
сохраняется лишь 20% от исходной активности пероксидазы.
Развитие фармацевтической и косметической
отраслей промышленности требует разработки и внедрения новых эффективных
препаратов, обладающих высокой конкурентоспособностью на рынке. Полученные
результаты подтверждают возможность, в дальнейшем, получения лекарственных форм
ферментов в сочетании с наноносителем, который будет обеспечивать стабильность
и пролангированность их действия.
Литература:
1.
Беруин, И.В.
Иммобилизованные ферменты / И.В. Беруин, М.Л. Клячко, А.В. Левашов. – М.:
Высшая школа, 1987.
2.
Краснопольский,
Ю.М. Некоторые аспекты технологии получения липосомальных форм лекарственных
препаратов / Ю.М. Краснопольский, А.Е. Степанов, В.И. Швец // Хим. Фарм. Журн.
– М., 1999.
3.
Мосолов, В. В.
Протеолитические ферменты / В.В. Мосолов. – М.: Наука, 1971. – 207 с.
4.
Тец, В. В.
Дезоксирибонуклеаза в терапии бактериальных и вирусных инфекций / В. В. Тец, Д.
Д. Генкин.-СПб. : Феникс, 2006. – 132 с.
5.
Александрова, Е. Ю.
Изучение пероксидазной активности в экстрактах из корневища и корней хрена и её
стабильности к различным воздействиям / Е. Ю. Александрова, М. А. Орлова, П. Л.
Нейман // Вестник Московского Университета. Серия 2. Химия.- 2006.- №5.- С.
350-352.
6.
Газарян, И. Г.
Особенности структуры и механизма действия пероксидаз растений / И. Г. Газарян,
Д. М. Хушпульян, В. И. Тишков.- М., 2006.- С.303-330.