Химия и химические технологии / 8. Кинетика и катализ
Серикбаев Б.А.,
Алтайбаев Б.Т., Аблина Г.Б., Камысбаев Д.Х., Тилепберген Ж.Ж., Ахмет О.
АО: «Институт
органического катализа и электрохимии им. Д.В. Сокольского», КазНТУ им. К.И.
Сатпаева, КазНУ им. аль-Фараби г. Алматы
ЭЛЕКТРОХИМИЧЕСКИЕ СВОЙСТВА МОДИФИЦИРОВАННОГО КОКСУЙСКОГО ШУНГИТА С
ИОНАМИ МЕТАЛЛОВ Fе и Cо.
Перспектива использования углеродных матриц в качестве
носителей микро - и нанодисперсных частиц металлов обусловлена стабилизирующим
действием данных материалов [1, 2]. Электропроводящие свойства углеродной
матрицы и развитая поверхность нанесенного металла делают возможным
использование композитов в качестве электрокатализаторов [3, 4].
Модифицирование углеродных носителей металлом повышает их
кислородопоглотительную способность, что связано не только с восстановительными
свойствами углей, но и высокой реакционной способностью дисперсного металла.
Металлосодержащие композиты могут быть синтезированы на основе минерального
сырья (шунгита), в отличие от специально создаваемых электронообменников [5, 6].
В этой связи были поставлены эксперименты по
модифицированию Коксуйского шунгита с различными металлами. Методом пропитки из
карбоксилатов Fе, Cо получены образцы модифицированного шунгита, которые
путем восстановления в токе водорода в инертной среде переводились в их
восстановленные формы.
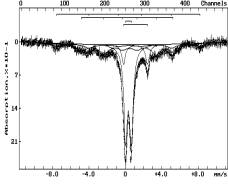
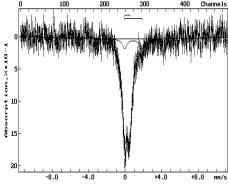
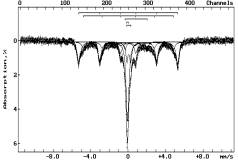
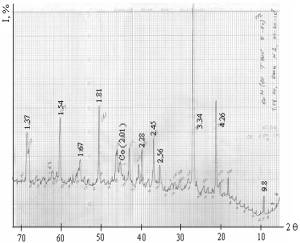
С
помощью Мессбауэровской спектроскопии исследовался процесс термической
обработки Коксуйского шунгита. Спектры снимались на спектрометре СМ 2201 и
приведены на рисунке 1. Исходный шунгит (1) содержит около 90% смеси
гидроксидов железа в магнито-упорядоченном и парамагнитных состояниях, а также
более 10% состояния Fe2+.
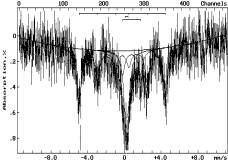
Прогрев
шунгита при 893K в Ar (2) приводит к изменению фазового состава. Возникает
фаза Fe3-xMxO4 (в
спектре - три зеемановских секстета, М – металл стоящий слева от железа в
периодической таблице). Кроме того, спектр показывает присутствие Fe3+ в
парамагнитном состоянии (более 20%) и Fe2+ (более 20%).
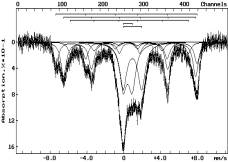
При
повышении температуры до 1293К (3) появляется a-Fe, а также
магнитоупорядоченная фаза близкая по параметрам к a-Fe, часть атомов
в кристаллической решетке, которого замещена атомами элементов, стоящими слева
от железа в периодической системе. Кроме того, присутствуют парамагнитные
состояния ионов Fe2+ и Fe3+.
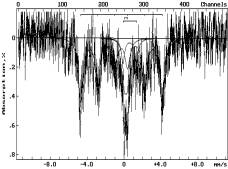
Прогрев
шунгита в токе H2 (4) при 493К приводит к исчезновению из спектра
магнитоупорядоченных состояний. Спектр представляет собой наложение двух
дублетов, отвечающих Fe3+ (около 90%) и Fe2+ (~10%).
Исчезновение из спектра магнитоупорядоченных состояний можно связать с высокой
дисперсностью гидроксидных фаз железа, присутствующих в шунгите.
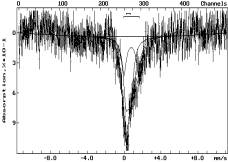
При 593К в токе H2 (5) наблюдается интенсивный процесс восстановления.
Спектр показывает наличие тех же двух форм железа Fe3+ и Fe2+,
но последней формы уже более 40%.
При 693К (6) происходит дальнейшее восстановление, появляется
железо в металлической форме (около 60%). Присутствует также Fe3+ (более 25%) и Fe2+ (около 15%). При 793К (7) процесс
восстановления продолжается, железо в металлической форме составляет уже около
75%, формы Fe3+
и Fe2+ - соответственно более 15% и около 10%.
|
1 |
4 |
|
2 |
5 |
|
3 |
6 |
|
7 |
|
Обозначение:
на воздухе: 1-293К; в атмосфере аргона: 2-893К, 3-1293К; в атмосфере водорода:
4-493К, 5-593К, 6-693К, 7-793К
Рисунок 1 - Мессбауэровские спектры шунгита
Анализ полученных результатов показывает, что процесс
восстановления железа в шунгите протекает последовательно, через стадию Fe2+.
Замена водородной атмосферы на кислородсодержащую при комнатной температуре не
приводит к полному окислению металлического состояния железа, происходит лишь
некоторое уменьшение количества последнего (до 61%), и увеличения содержания форм Fe3+ и Fe2+ (до 19 – 20%).
Методика имеет перспективу в получении новых
электродных материалов для осуществления электрокаталитических процессов с
участием органических соединений.
Был
дополнительно произведен физико-химический анализ, как исходных материалов, так
и модифицированных с помощью рентгеновского дифрактометра X'Pert MPD PRO (PAN alytical)
и низковакуумного растрового электронного микроскопа в комплекте с системой
энергодисперсионного рентгеновского микроанализа Jeol JSM-6490 LA.
Анализ фазового
состава образцов показал, что основными фазами в нем являются кварц, графит,
широкий перечень алюмосиликатных структур, в том числе – мусковит, биотит,
флогопит и др. Из элементов представлены все перечисленные выше, в том числе
кальций, фосфор, натрий и сера. Результаты рентгенофазового анализа приведены в
таблицах 1 и 2.
Образцы
модифицированного шунгита с различным содержанием ионов железа и кобальта,
получены методом пропитки из их уксуснокислых солей. Наличие восстановленных
форм ионов металлов подверглись рентгеновскому микроанализу. Массовые
содержания модифицирующих металлов в шугните находятся в пределах ошибки
экспериментов. На основании данных, приведенных в таблицах 1 и 2 можно судить
об образовании новых композитов с диспергированными частицами железа и кобальта
в шугните. Наличие металлов и их восстановленных форм могут быть подтверждены и
с помощью РФА и электрохимическим методом.
Таблица 1 – Результаты элементного рентгенофазового анализа шунгита модифицированного железом
|
Элемент |
Шунгит модиф. Fe
(5%) при 200 0С, |
Шунгит модиф. Fe
(15%) при 200ºС, |
Шунгит модиф. Fe
(5%) при 400ºС, |
Шунгит модиф. Fe
(10%) при 400ºС, |
Шунгит модиф. Fe (15% ) при
400ºС, |
|
Mасс. % |
Mасс. % |
Mасс. % |
Mасс. % |
Mасс. % |
|
|
С |
13,4 |
21,4 |
24,78 |
21,4 |
14,86 |
|
О |
43,3 |
32,9 |
44,81 |
36,0 |
19,67 |
|
Al |
14,28 |
5,4 |
4,95 |
5,1 |
4,09 |
|
Si |
18,64 |
20,2 |
18,75 |
22,0 |
29,27 |
|
Na |
- |
- |
0.8 |
- |
- |
|
К |
6,34 |
2,0 |
1,41 |
1,2 |
3,76 |
|
Fe |
4,3 |
15,2 |
4,56 |
4,8 |
28,34 |
|
Ва |
- |
2,64 |
- |
- |
- |
|
Mg |
- |
- |
0,74 |
- |
- |
Таблица
2 –
Результаты элементного рентгенофазового анализа шунгита модифицированного кобальтом
|
Элемент |
Шунгит модиф. Со (10%) при 200 0С, |
Шунгит модиф. Со (15%) при 200ºС, |
Шунгит модиф. Со (10%) при 400ºС, |
Шунгит модиф. Со (15%) при 400ºС, |
|
Mасс. % |
Mасс. % |
Mасс. % |
Mасс. % |
|
|
С |
19,13 |
17,61 |
25,95 |
18,7 |
|
О |
41,68 |
29,94 |
34,96 |
37,8 |
|
Al |
5,37 |
5,09 |
5,31 |
4,8 |
|
Si |
19,40 |
30,42 |
19,91 |
22,7 |
|
К |
2,31 |
1,94 |
1,47 |
1,4 |
|
Fe |
4,23 |
6,39 |
7,86 |
3,4 |
|
Сo |
7.87 |
8,61 |
4,54 |
10,9 |
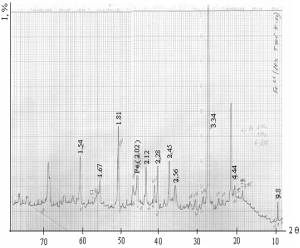
Методом
рентгенофазового анализа были проведены исследования образцов модифицированных
шунгитов, полученных в токе аргона и водорода при 4000С. На рисунке
2 А представлена диаграмма РФА для шунгита с 10% железом.
Обнаружено, что на
рентгенограммах присутствуют рефлексы характерные для α-кварца и
мусковита, которые присутствуют в исходном образце шунгита, также имеется
рефлекс при 2,02 для α-Fe (ASTM 6 – 696), что указывает на наличие дисперсных частиц
железа в полученном нами образце. По результатам рентгеноспектрального анализа
было установлено, что во взятых для исследований шунгитов содержится более 60 %
оксида кремния, и около 10 % оксида алюминия. Кроме того, в шунгите найдены
оксиды различных металлов, также обладающих адсорбционными свойствами к
органическим соединениям.
|
А |
Б |
Рисунок 2 – РФА модифицированного c Fe+2 (10%) и Co+2 (10%) шунгита при t = 4000С (2 ч.)
Результаты
рентгенофазового анализа модифицированного шунгита c Co+2 (10%) при t = 4000С (2 ч.) показаны на рисунке 2Б, на
котором проявляется рефлекс для металлического Со при 2,01 (ASTM 15 – 806).
Дальнейшие исследования
были направлены на установление закономерностей электрохимического поведения шунгита модифицированных с Fe и Co. Для этого
были сняты ЦВА УПЭ, приготовленного на основе синтезированных композитов.
Электрохимические измерения проводились в следующих
буферных растворах: тетраоксалат калия КН3(С2О4)2
– рН=1,65, гидрофталат калия КНС8Н4О4 –
рН=4,01 и тетраборат натрия 10-водный Nа2В4О7
– рН=9,18.
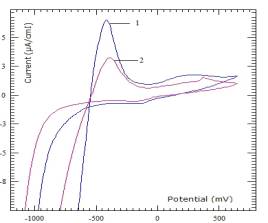
На следующем рисунке 3 показано сравнительные
циклограммы шунгита (кривая 1) и ЦВА шунгита модифицированного частицами Fe+2,
восстановленными в токе водорода в количестве 5% по массе (кривая 2). Условия
регистрации ЦВА приведены под рисунком. Полученные ЦВА показывает
удовлетворительную зависимость аналитического сигнала от количества активной
частицы (Fe), как в катодной, так и в
анодной области изменения потенциалов. При выбранных условиях проведения
экспериментов: рН среды, V-скорости
развертки и др. параметров можно анализировать содержание модифицирующих
добавок катализаторов методом снятия ЦВА на УПЭ.
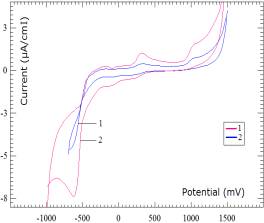
Обозначения:
1-шунгит; 2- модифицированный c 5% Fe+2 шунгит
Рисунок 3 - Циклические вольтамперограммы, снятые при pH=4,01 и V=1000мВ/min
На рисунке 4 приведены результаты циклической вольтамперограммы шунгита
модифицированного c 5% Fe+2 от
количества цикла (N), снятые при pH=4,01 и V=500мВ/min. Рассмотрение катодной области циклограмм
показали прямопропорциональную зависимость максимума с ростом количества цикла,
что указывает на диффузионный катодного пролцессак при выбранной скорости
измерений.
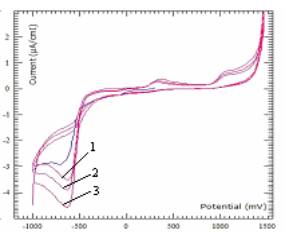
Обозначения:
1-N=1; 2- N=2; 3- N=3
Рисунок 4 - Циклическая вольтамперограмма шунгита модифицированного c 5% Fe+2 от количества цикла (N), снятые при pH=4,01 и V=500мВ/min
Исследование композиционной системы, полученной путем
пропитки шунгита Со(NO3)2
из расчета с содержанием последнего на носителя равным 10% проводилось в буферном
растворе тетраоксалата калия (рН=1,65). Результаты вольтамперометрических
измерений приведены на рисунке 31. Начало снятия циклограммы осуществлялось
путем поляризации электрода в катодную область при значении Енач.=
-100 мВ до Екон.= -1000 мВ, с задержкой потенциала при Екон.
Далее исследовалось поведение УПЭ из шунгита модифицированного с содержанием
10% кобальтом. Время задержки при Екон. равнялось 1 минуте.
Исследовалось влияние количества циклов на ход циклограмм в интервале изменения
Е от -1000 мВ до Е=1200 мВ. Как видно из ЦВА на анодной ветви наблюдается две
волны окисления, которые соответствуют потенциалам -400 мВ (для кобальта) и 400
мВ (для железа). Причем, анодный пик соответствующий 400 мВ имеет форму горба,
что может быть связанным с дальнейшим окислением Со+2, наряду с
окислением железа, присутствующего в природном шугните. При значениях
потенциалов выше 1000 мВ могут протекать реакций окисления железа и разложения
воды. Обратный ход ЦВА характеризуется наличием трех катодных пиков при потенциалах
400 мВ, 100 мВ и -400 мВ, что могут быть отнесены к восстановлению высших
оксидов кобальта (пики при 400 мВ и 100 мВ) и восстановлению Со+2
(пик при -400 мВ). В пользу данного рассуждения свидетельствует результаты
исследований, которые приводятся на рисунке 6. Следует отметить заметное
снижение величин токов максимума от числа цикла для всех пиков, что может быть
объяснено с уменьшением поверхностных концентраций кобальта и железа за счет
химических реакций их растворения при этих значениях рН-раствора.
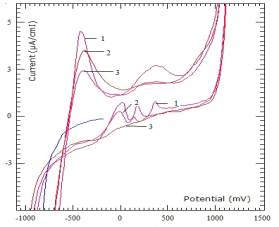
Обозначения:
1-N=1; 2- N=2; 3- N=3
Рисунок 5 - Циклическая вольтамперограмма шунгита модифицированного c 10% Co+2 от количества цикла (N), снятые при pH=1,65 и V=1000мВ/min
На следующем рисунке 6 потенциал анодной поляризации
ограничен значением 750 мВ, т.е. до значении потенциалов образования высших
оксидов кобальта и железа. Характер ЦВА на катодном участке сильно отличается
от полученных зависимостей, приведенных на рисунке 5. На катодной ветви ЦВА
отсутвуют волны, соответствующие восстановлению высших оксидов кобальта, что
подверждает наши предположения относительно их происхождения. Заметным фактом
также является снижение тока максимума окисления кобальта при Е=-400 мВ, что
указывает на наличие поверхностных ограничений скорости растворения кобальта.
Обозначения:
1-V=500
мВ/min; 2-V=1000 мВ/min
Рисунок 6 - Циклическая вольтамперограмма шунгита модифицированного c 10% Co+2 от количества цикла (N), снятые при pH=1,65
Поведение шунгита модифицированного 10% Со в буферной
системе тетрабората натрия Na2B4O7·7H2O, соответствующий рН=9,18 показано на рисунке7. Анализ
экспериментальных данных показали образование стабильного поверхностного
состояния композита, с частицами оксидов кобальта. При анодных потенциалах выше
1000 мВ наблюдается волна каталитического выделения кислорода, что показывает
образование редокс- системы, состоящий из частиц кобальта переменной
валентности. На вставке приведены данные в увеличенном масштабе, где отчетливо
видна волна растворения кобальта, которая смещена в анодную область, что не
противоречить данным для подобных процессов с изменением рН-среды.
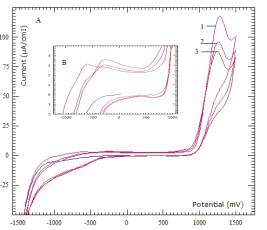
Обозначения: 1-N=1; 2- N=2; 3- N=3
Рисунок 7 - Циклическая вольтамперограмма шунгита модифицированного c 10% Co+2 от количества цикла (N), снятые при pH=9,18 и V=1000мВ/min
Литература:
1 Тарасевич М.Р.
Электрохимия электродных материалов. М.: Наука, 1984. - 243 с.
2 Rivas G.A., Rubianes M.D., Pedano M.L. Carbon nanotubes paste electrodes.
Analytical
applications // International Society of Electrochemistry – 55th Annual
Meeting, 19-24 September, Thessaloniki, 2004, abstracts.
3 Зикрина З.А.,
Гладышева Т.Д., Подловченко Б.И. Получение и свойства электролитических осадков
иридия на углеродной ткани // Электрохимия. 1990. Т.26. С. 460-465.
4 Takasu Y.,
Kawaguchi T., Sugimoto W., Murakami Y. Effects of the surface area of carbon
support on the characteristics of highly-dispersed Pt-Ru particles as catalysts
for methanol oxidation // Electrochim. Acta.
- 2003.- V.48.- P.3861-3868.
5 Субботина А.А.,
Кругликова Н.М. Исследование процесса очистки инертных газов от примеси
кислорода с помощью электронообменников различного типа // Первая
научно-техническая конференция молодых ученых и специалистов Уральской зоны, -
Свердловск, 1974. - С.69-70.
6 Шаталов А.Я.,
Кравченко Т.А., Александрова З.Ф. и др. Исследование редокситов IV. Скорость обескислороживания воды зерненными
медьсодержащими редокситами ЭИ-5, ЭИ-5у, ЭИ-12 и ЭИ-21 // Журн. физ. химии. -
1974.- Т.48.- С.905-908.