УДК 536.24:
661.716.1
ИССЛЕДОВАНИЕ
НАГРЕВА МЕТАНА НА НАСАДКАХ ИЗ ZrO2 И Al2O3 :
ЭКСПЕРИМЕНТ И РАСЧЁТ.
В.С. Игумнов, Я.М. Визель, Вавилов С.Н., Тепляков
И.О., Гусева А.А., Кубриков К.Г., Мамайкин Д.С., Виноградов Д.А.
Объединённый институт высоких температур РАН,
Москва
Введение В
предыдущей работе [1] было показано,
что при каталитической конверсии углеводородов в обогреваемых трубах промежуточный
перегрев реагирующей смеси с отношением СН4/(Н2О и(или)
СО2) < 1,5 на инертных
(ингибирующих) насадках позволяет резко улучшить технологические параметры
процесса каталитической конверсии в трубчатой печи, в том числе увеличить
производительность по целевому продукту, за счёт увеличения подвода тепла в
зону реакции. Поэтому для проведения полномасштабного промышленного испытания процесса конверсии в промышленном агрегате необходимо
более полное исследование физической химии нагрева метана. Были проведены
экспериментальные исследования нагрева метана до температуры ~ 1200К без
выделения углерода. В процессе нагрева
метана на начальной стадии образуется
водород и углеводороды. Экспериментально получено – свободный углерод в
нагреваемом метане не выделяется до тех
пор, пока не образуется более 2% об
водорода. Экспериментально определенные временные интервалы нагрева
метана при разных параметрах до начала выделения свободного углерода подтверждают выводы, полученные при
использовании кинетических особенностей взаимодействия между молекулами
газа с молекулами твердого тела, передающего тепло к газу [2].
Экспериментальная
часть.
Эксперименты
по нагреву метана (природного газа) проводились на установке, рабочий участок
которой изображён на рис.1. Цель
эксперимента – нагреть метан без выделения углерода до температуры 1200К.
Известно, что углерод образуется из метана по следующей цепи химических
превращений:
СН4 → С2Н6
→ С2Н4 → С2Н2 →
С (1)
В зависимости от материала насадки, на котором
происходит нагрев метана, меняется время с разложения метана до момента, когда
образуется углерод. В [3] эксперименты проведены с гранулами насадки,
изготовленными из ZrO2 и Al2O3. Экспериментально установлено, что в процессе нагрева метана
свободный углерод не появляется до тех
пор, пока содержание водорода в нагреваемом метане не превысит 2% об. При этом на
гранулах, содержащих, например, СаО более 2%
водорода появляется при температуре менее 800К и соответственно
образуется свободный углерод.
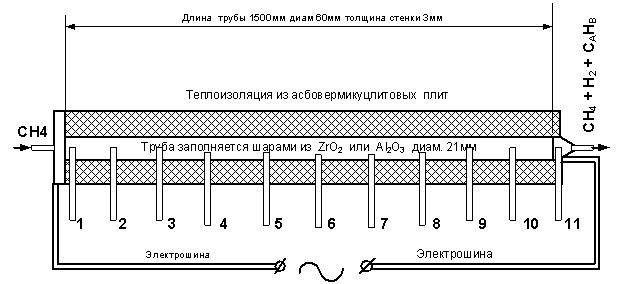
Рис.1 Обогреваемая труба для исследования
нагрева метана без выделения углерода на
шаровых насадках из ZrO2 И Al2O3. Цифрами 1,2,3…..11
обозначены пробоотборники нагреваемого метана для хроматографического анализа с одновременным измерением
температуры.
Экспериментальная труба обогревалась прямым пропусканием
переменного электрического тока от 700А до 1200А. Ток регулировался напряжением
5-50В. Такой обогрев даёт возможность нагреть трубу до температуры 1500К, при
равномерном распределении температуры стенки.
Труба на всю длину заполнялась шарами: в первом случае шарам из ZrO2, во
втором из Al2O3. Шары
были диаметром 21 мм для обоих
вариантов. Давление и Температура
нагреваемого метана измерялась в 11 сечениях хромель-алюмелевыми термопарами,
там же производился отбор газа на хроматографический анализ для определения
содержания водорода в нагреваемом метане.
Пороговая чувствительность хроматографа по концентрации водорода была
2,8×10-4 % об. точность измерения концентраций водорода
составляла 2%. Определение образования
свободного углерода проводилось фильтрами в местах отбора газовых проб.
Интенсивное выделение углерода на гранулах могло фиксироваться по перепаду
давления. Температура газа для сравнения с экспериментом определялась расчётом
в предположении гомогенизации
внутренней среды реактора с определением эффективной теплопроводности. Расход
газа, давление в реакторе и температура стенки являлись задаваемыми
параметрами. В заданном режиме реактор работал 5 часов, выход на стационарное
состояние всех параметров наблюдался в течение 30 минут.
Результаты и обсуждение
В таблице 1 приведены результаты 8
экспериментов: 4 режима на ZrO2 и 4 режима на Al2O3. Общая длительность экспериментов на каждой из насадок
по 20 часов, по оценкам [3] этого времени достаточно для получения достоверных
выводов о выделении углерода на гранулах. В таблице 1 представлены параметры,
характеризующие исследуемый процесс нагрева метана. В 3 столбце представлена
максимальная температура метана при нагреве (Тmax). 3 столбец показывает среднее давление в трубчатом
реакторе. 5 столбец массовый расход метана. 6 столбец константа равновесия для
общей реакции разложения метана СН4 =
С + 2 Н2 при средней температуре газа по длине реактора. Столбцы 7 и 8 показывают равновесную концентрацию СН4 и Н2 (в предположении
отсутствия выделения углерода), если бы метан находился достаточно долго при
максимальной температуре метана, наблюдаемой в заданном режиме. Столбец 8
представляет измеренную концентрацию водорода на выходе из реактора. Столбец 9 устанавливает концентрацию
водорода, полученную расчетом. Расчет осуществлен согласно зависимости
Аррениуса. Реактор разбивался на 10 участков, в которых предполагалась
изотермия. Для каждого реактора получены энергия активации (Е) и
предэкспоненциальный множитель (К0). Хорошее совпадение расчета с
экспериментом связано с тем, что эти константы получены для условий
эксперимента. Для реакторов другой формы и размеров с насадками тоже другой
формы, размеров результаты будут значительно хуже. Следует обратить внимание на режим 7, в котором измеренная
концентрация водорода составила 2,12% об. В этом случае установлен эффект
образования свободного углерода отмечено фильтром на выходе из реактора. Это явление наблюдалось во всех опытах,
где концентрация водорода на выходе превышала 2% об. Далее в 11 столбце средняя скорость течения метана по реактору и
12 столбец время нахождения метана в реакторе.
Перечисленные результаты можно использовать для качественной оценки
эффективности нагревателя метана при нагреве метана до 1000К. Для иллюстрации
процесса разложения метана по формуле (1) представлена таблица 2.
Таблица 1
|
|
№ Реж. |
ТК макс. |
Р кПа |
G CH4 г/с |
кр Константа равновесия |
Термодинамически равновесный состав при
Тмакс, % об. |
Н2 Эксперимент, выходн, % об. |
Н2 Расч.
На выходе, %
об. |
WЭ м/с скорость газа, отнесённая к
свободному сеч. |
∆τ с время пребывания газа в реакторе |
|
|
СН4 |
Н2 |
||||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
|
ZrO2 |
1 |
1170 |
20 |
0,22 |
0,0252 |
26,9 |
73,1 |
0,8 |
0,85 |
4,41 |
0,34 |
|
2 |
1150 |
10 |
0,17 |
0,0290 |
19,0 |
81,0 |
0,73 |
0,74 |
7,14 |
0,21 |
|
|
3 |
1110 |
80 |
0,17 |
0,0390 |
57,4 |
42,6 |
0,45 |
0,49 |
0,89 |
1,69 |
|
|
4 |
1050 |
30 |
0,11 |
0,0586 |
48,1 |
51,9 |
0,44 |
0,45 |
1,52 |
0,99 |
|
|
Al2O3 |
5 |
1020 |
20 |
0,11 |
0,0857 |
47,4 |
52,6 |
0,46 |
0,45 |
2,31 |
0,65 |
|
6 |
1080 |
20 |
0,17 |
0,0502 |
38,3 |
61,7 |
1,61 |
1,67 |
3,66 |
0,41 |
|
|
7 |
1050 |
30 |
0,11 |
0,0651 |
49,4 |
50,6 |
0,73 |
0,79 |
1,56 |
0,96 |
|
|
8 |
1100 |
80 |
0,17 |
0,0426 |
58,6 |
41,4 |
2,12 |
2,18 |
0,88 |
1,70 |
|
В этой таблице показаны наиболее вероятные превращения
на начальной стадии пиролиза метана. В
реальном процессе нагрева метана превращений значительно больше, чем в таблице
2. Выбраны наиболее значимые реакции. В таблице представлены рассчитанные
значения основных параметров реакций, для случая проектирования нагревателей
метана с широким диапазоном требуемого значения нагрева.
Таблица 2.
|
№ |
РЕАКЦИИ |
Приведенная
энергия Гиббса, кДж/моль
К |
Тепловой
эффект реакции при 298К, кДж/моль |
Тепловой
эффект реакции при 1000К, кДж/моль |
Энергия Гиббса при 1000К, кДж/моль |
ℓg Kp |
|
|
1 |
2 |
3 |
4 |
5 |
6 |
|
1 |
2СН4 = С2Н6 + Н2 |
-0,006 |
65,03 |
73,37 |
71,05 |
-3,71 |
|
2 |
2СН4
= С2Н4+2Н2 |
0,122 |
201,98 |
217,97 |
79,77 |
-4,17 |
|
3 |
2СН4
= С2Н2+3Н2 |
0,245 |
376,45 |
425,62 |
131,49 |
-6,8 |
|
4 |
СН4
= С + 2 Н2 |
0,09 |
74,85 |
89,89 |
-15,15 |
0,79 |
|
5 |
С2Н6
= С2Н4+ Н2 |
0,128 |
136,95 |
144,35 |
8,71 |
-0,45 |
|
6 |
С2Н6 = 2С + 3 Н2 |
0,186 |
84,67 |
255,54 |
101,67 |
5,29 |
|
7 |
С2Н4 = 2С + 2 Н2 |
0,058 |
-52,28 |
-38,18 |
-110,07 |
5,7 |
|
8 |
С2Н4 + Н2 = С2Н6 |
- 0,128 |
-136,95 |
-144,35 |
-8,75 |
0,52 |
Данные, приведенные в табл.2, необходимо учитывать при создании новых
технологических процессов (при проектировании нужно анализировать и ряд других
менее вероятных химических превращений), когда необходимо, для улучшения общего
процесса, нагреть метан до температуры 1000К. Например, (строка 3) при
плазменном производстве ацетилена из природного газа.
На рис.2
и рис.3 представлены результаты 7 опытов при разных режимах. Видно, что
нарастание по длине реактора
концентрации водорода на ри.2 происходят не монотонно в отличие от рис.3. Этот
феномен воздействия ZrO2 на пиролиз метана пока ещё не
ясен. Температура нагреваемого
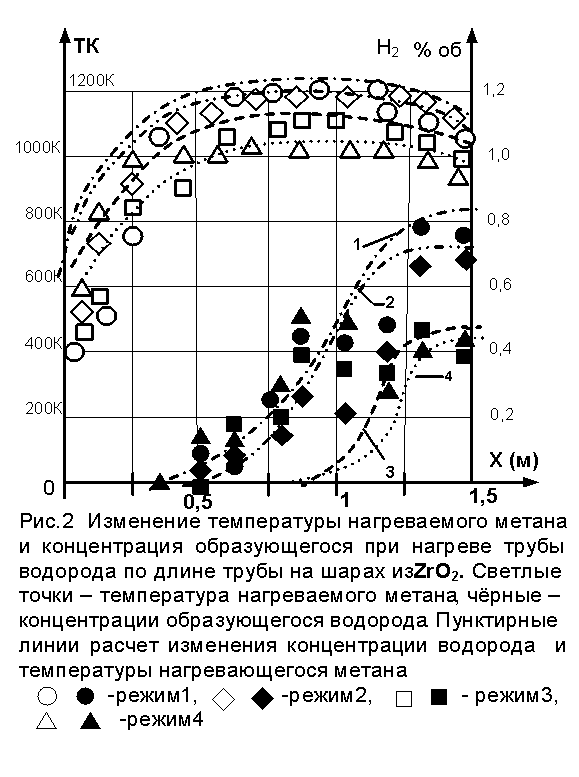
метана на рисунках достигает известного максимума и
снижается к выходу трубы. Это связано с температурой стенки реактора, которая
заметно падает на выходе газа из трубы, что связано со стоками тепла в
окружающую среду. Расчетные кривые температуры нагреваемого газа получены согласно квазигомогенной модели
дисперсной среды реактора.
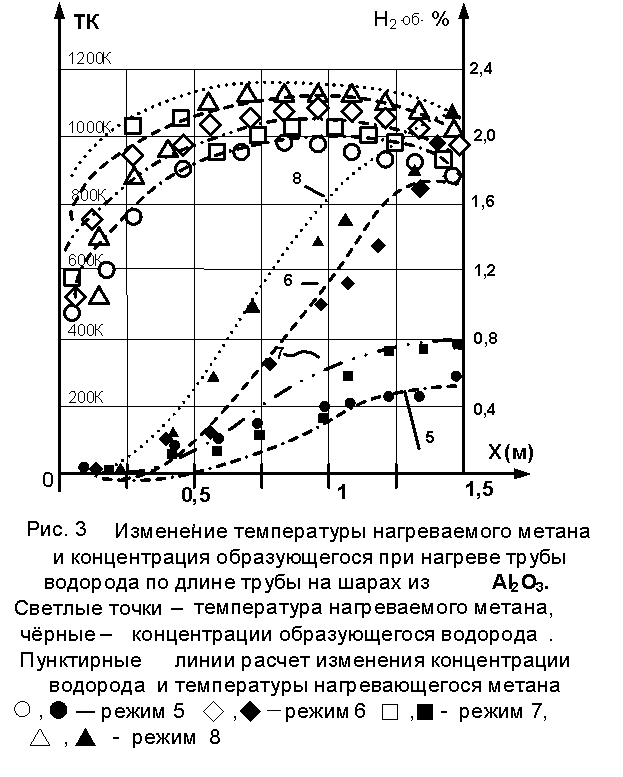
Следует обратить внимание на режиме 4 и
7. Здесь сделана попытка сформировать
одинаковые режимы на ZrO2 и Al2O3. Но это не
удалось, т.к. теплопроводность этих насадок сильно отличается у ZrO2 λ = 2
– 3 Вт/м К, а у Al2O3 λ = 25
– 30 Вт/м К. Поэтому, согласно
расчётной модели нагрева газа [3], если максимальная температура и давление
одинаковы, то другие режимные характеристики должны отличаться.
Расчет
конечной концентрации водорода с использованием кинетической теории газов.
Практически все работы, посвящённые
кинетике выделения водорода при нагреве метана, связаны с определения
Аррениусовских параметров в соответствие с реакцией
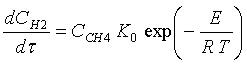 (1),
(1),
предэкспоненциального множителя К0 (1/c) и энергия активации Е, (кДж/ моль).
Значения предэкспоненциального множителя и
энергии активации определены по
методике, предложенной в [4], и равны К0 = 1,32 Е +14 1/с для
всех экспериментов, EZrO2 = 339 кДж/моль для насадки из двуокиси циркония и EAl2O3 = 306 кДж/моль для насадки из корунда. Эти величины
находятся в диапазоне значений Аррениусовских параметров, определённых в [4].
Для расчёта реактор разбивался на 10 изотермических участков (по числу
измерительных сечений), в каждом из которых вычислялось изменение концентрации
водорода. Результаты расчёта конечных концентраций водорода приведены в таблице
1, изменение температуры нагреваемого газа и концентрации водорода по длине
реактора показано на рис.2 и 3.
Возможен
другой подход к расчёту концентраций водорода при пиролизе метана. Экспериментально показано, что термический
крекинг метана является гетерогенной реакцией: скорость реакции практически
линейно зависит от s/v, где s - площадь
твёрдой поверхности в зоне реакции, v – объём
зоны реакции. В таблице 2 приведены 8 основных реакций, проходящих при пиролизе
метана и их термодинамические параметры (мы не рассматриваем реакции с
образованием радикалов, т.к. они явно являются промежуточными). В начальной
стадии разложения метана (Δτ ~1с), для расчета концентрации
образующегося водорода выделим, как наиболее термодинамически вероятную
для накопления водорода, реакцию
образования этана из метана:
2CH4 → C2H6 + H2 (3),
и будем рассматривать её в нашем подходе к расчёту
концентрации водорода.
При упаковке шаров диаметром 21 мм в
цилиндр внутренним диаметром 54 мм объём, занятый шарами, составляет ~74% от
внутреннего объёма цилиндра. Следовательно, в цилиндре длиной 1500 мм
помещается 89 шаров с общей поверхностью s = 0,492 м2, при этом s/v= 553 1/м без
учёта внутренней поверхности реактора из нержавеющей стали. Площадь поверхности нагреваемой части
реактора – 0,034 м2.
Далее оценим скорость реакции (2), исходя
только из кинетической теории газов в предположения о гетерогенности реакции
пиролиза и теории столкновений [2].
Экспериментально установлено, что реакция (2) происходит только при
взаимодействии молекулы метана из газа с адсорбированной на поверхности шаров
молекулой. При достижении значения кинетической энергии молекулы в газе,
превосходящем значение энергии активации на двуокиси циркония или корунде,
происходит соответствующее химическое
превращение.
Для дальнейшего развития предлагаемой
модели перейдём к адсорбции. Поскольку, мы имеем дело с достаточно высокими
температурами и практически гладкой поверхностью адсорбции, то естественно воспользоваться моделью монослоя (изотермой
Ленгмюра). Согласно заданной схеме, определим степень заполнения поверхности
адсорбированными молекулами (θ). Высокие температуры и гладкие поверхности,
фигурирующие в наших экспериментах, позволяют рассчитать изотермы Ленгмюра [5],
начиная с давления ~ 10 кПа. В этом
случае содержание адсорбированного вещества остаётся постоянным, и можно с
достаточной точностью принять θ = 0,1 (фактически θ меняется от 0,05
до 0,1). Такой же результат дают
экспериментально полученные «изотермы полного содержания» метана на активированном
угле, полученные в [6].
Течение газа происходит в сильно
загромождённой трубе (напомним, что шары занимают 74% объёма и s/v = 553 1/м),
число единичных молекул метана, которые в единицу времени сталкиваются с
единицей поверхности насадки, равно
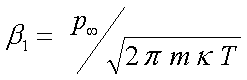 ,
(3)
,
(3)
где m – масса
одной молекулы.
Поскольку при выводе формулы (3) учитываются только нормальные к поверхности насадки компоненты скорости
молекул, то для взаимодействия молекулы газа из потока с адсорбированной
молекулой «стерический фактор» в данной модели расчёта может быть принят равным
единице.
Вернёмся вновь к величине энергии активации. Физический смысл энергии активации,
используемый в нашей модели, точно такой же, как и в уравнении Аррениуса: это
минимальное значение кинетической энергии двух молекул метана, при
взаимодействии которых происходит элементарный (молекулярный) акт
взаимодействия по реакции (2). Различие
заключается в том, что по Аррениусу это – взаимодействие двух молекул в газе,
по нашей модели – это взаимодействие молекулы из газа с адсорбированной на
поверхности шара молекулой.
Известно, что по распределению Максвелла
наиболее вероятная скорость молекулы в газе:
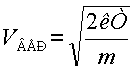 (4)
(4)
Распределение Максвелла молекул по
скоростям можно записать для
относительных скоростей ![]() и если вместо энергии
активации использовать скорость активации
и если вместо энергии
активации использовать скорость активации 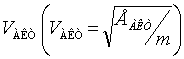 , то число
молекул, скорость которых превосходит скорость активации
, то число
молекул, скорость которых превосходит скорость активации
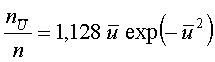 (5)
(5)
Таким образом, в рамках предлагаемой
модели скорость образования молекул водорода в лабораторном реакторе NH2 можно
записать следующим образом:
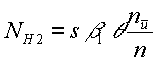 (6)
(6)
где s – общая поверхность шаров насадки в реакторе, β1
определено по (3), θ – степень заполнения при адсорбции метана на
поверхности насадки, nu/n определено по
(5). Энергии активации, принятые для расчётов по нашей модели, EZrO2 = 135, EAl2O3 = 130 кДж/моль, что также находится в диапазоне,
определённом в [4].
Количество молекул метана, поступающего в
реактор, определяется по экспериментально измеренному массовому расходу метана GCH4,
приведённому в таблице 1 NCH4 = GCH4/M · NA(молекул/с),
где М – молекулярный вес метана, NA – число
Авогадро.
Следовательно, расчётная объёмная
концентрация водорода по предлагаемой модели
CH2 = NH2/NCH4, ввиду
малости концентраций водорода мы пренебрегаем убылью метана по реакции (2).
Сравнение рассчитанных и экспериментально
измеренных на выходе из реактора концентраций водорода приведено в табл. 3.
Таблица 3
|
Материал насдки |
ZrO2 |
Al2O3
|
||||||
|
№ режима |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
Расчет % об |
0,884 |
0,43 |
2,17 |
0,722 |
0,49 |
0,738 |
0,973 |
0,832 |
|
Эксперимент % об |
0,8 |
0,73 |
0,45 |
0,44 |
0,47 |
1,61 |
0,73 |
2,12 |
Из таблицы 3 видно, что предложенная
модель пиролиза в том виде, как она использована здесь, вполне может служить
первым приближением для расчёта конечных концентраций хотя бы потому, что в
чисто молекулярных расчётах совпадение порядков уже считается хорошим
достижением. Вместе с тем видно, и как отмечалось выше, аррениусовская методика
даёт хорошие результаты только для устройств с очень близким размерам и форме
экспериментального реактора [4]. Результаты расчета для случая, когда размеры
отличны в 2 раза могут отличаться на порядок. Расчеты по предложенной модели
дает концентрации водорода на выходе для
ZrO2 и Al2O3 вне зависимости от размеров реактора и формы с
размерами гранул размещенных в реакторе.
С точки
зрения совпадения расчёта с экспериментом уравнение Аррениуса не более надёжно,
т.к. там два эмпирических коэффициента (предэкспоненциальный множитель и
энергия активации), а не один (энергия активации), как у нас. В реакторах
больших размеров результаты будут не только низкой точности, но и не будут иметь конкретного физического
смысла. При этом в нашей модели энергия
активации имеет очевидный физический смысл и берётся прямо из распределения
Максвелла.
Рассмотрим
наиболее сильно отличающийся результат для режима 3. Здесь большое время пребывание в реакторе и малая
скорость течения газа (похожая ситуация в режиме 8). Соответственно имеется
сильная накладка воздействия неучтённых пока
свойств ZrO2 . Тем не менее, при конструировании, исходя из
качественных соображений, можно дать рекомендации для формы и размеров
реального аппарата с учетом условий переноса тепла и скорости течения газа.
Проведённое исследование даёт очень важный для практики. Результат:
разложение метана при нагреве замедляется при использовании в качестве насадки двуокиси циркония, т.е. этот
материал является ингибитором разложения метана при нагреве, в расчётных методиках
это выражается в увеличении энергии активации процесса на ZrO2 по
сравнению с корундом.
Влияние двуокиси циркония на замедление
коксообразования при каталитической конверсии углеводородов в жёстких условиях
отмечен в [7] и на основании этого предложен катализатор с носителем из ZrO2 .
Обсуждение
использования ингибирующей насадки на действующих аппаратах.
Рассмотрим это на примере получения восстановительного
газа для металлизации окисленных железорудных окатышей на Оскольском
электрометаллургическом комбинате (ОЭМК).
Данные приводятся согласно технической
инструкции эксплуатации цеха металлизации рудных окатышей: ТИ 129 – ж – 08 – 86
и суточного рапорта от 10.11.2010. Производство металлизированных окатышей в
шахтной печи восстановление железа осуществляется смесью газов CO и H2. Смесь восстановительного газа производится в реформерах цеха металлизации
ОЭМК. 4 реформера имеют 288 труб каждый. Внутренний диаметр труб 0,2 м. Трубы
заполняют насадкой из Al2O3 и
катализатором различной активности. Насадка из Al2O3 имеет форму колец Рвшига размером
30×35×15 мм. Обогрев труб снаружи обеспечивается сжиганием
смеси природного и колошникового газов. Длина обогреваемой части труб 7,8 м.
Состав смешанного газа, подаваемого на конверсию, % об.: H2 – 40; N2 - 2,0; CH4 – 19,5; CO – 16; CO2 – 15,5;
Н2О – 7%. Именно этот газ должен быть подвергнут промежуточному перегреву по
методу каталитической конверсии, предложенному в [1]. Здесь необходим расчет длин слоёв гранул насадки из Al2O3 или шаров диаметром 35мм из ZrO2 . Расчет
будет проведен согласно методике определения температурного режима и скорости
химической реакции, предложенной в
настоящей статье.
Программа полномасштабного промышленного
испытания метода промежуточного перегрева на двух трубах реформера модуля
металлизации №3 ОЭМК разработана в ОИВТ РАН. В рамках этой программы должны
быть проведены дополнительные расчёты нагрева реальной рабочей смеси с
использованием методов, рассмотренных в данной статье. Программа полностью согласована с
руководством ОЭМК, и осталось лишь получить согласие разработчика и владельца
всей технологии прямого восстановления железа на ОЭМК американской фирмы Midrex Technology Inc.
Заключение.
Промежуточный перегрев реагирующей смеси
метан/окислитель на ингибирующих насадках даёт важные технологические
преимущества при каталитической
конверсии углеводородов: увеличение производительности по целевому продукту и
увеличение срока службы катализатора конверсии. Поэтому пиролиз метана на
ингибирующих насадках представляет практический интерес не только с точки зрения выделения/невыделения углерода
на гранулах насадки.
Экспериментально и теоретически рассмотрен
пиролиз метана на гранулах корунда (инерт) и двуокиси циркония (ингибитор) при
течении его в обогреваемой трубе. Показано ингибирующее влияние двуокиси
циркония на разложение метана.
Предложена новая расчётная модель пиролиза
метана, отличная от Аррениусовской, основанная на предположении, что разложение
метана происходит только при взаимодействии молекул из газа с молекулами,
адсорбированными на поверхности насадки, причём степень заполнения определяется
по изотерме Ленгмюра.
Литература
1. Игумнов В.С., Визель Я.М. ; Катализ в
промышленности. 2010, №6, с34.
2. Горбунов А.А., Иголкин С.И., Силантьева О.А. Ж. вычисл. матем. и матем. физ. 2009, Т49,
№5, С. 891-901
3. Igumnov V.S. “Technical and technological methods
of realization of steam catalytic conversion of natural gas with a methane-water
proportion close to stoichiomythic ratio” , Hydrogen materials science and
chemistry of carbon nanomaterial, NATO security science setias – A: Chemistry
and Biology, The NATO Programmer for
Security through science. Page
555-561. 2007.
4. Holmen A.,Olsvik
O.,Rokstad O., Fuel Process Technology. 1995. Vol.42. P. 249.
5. Рощина Т.М. Адсорбционные явления и поверхность. 1998.
«Химия»
6. Толмачёв А.М. Термодинамика адсорбции газов, паров
и растворов. 2008. Учебно-методическое пособие. Хим. фак. МГУ
7. Ван ден Остеркамп П.,Вагнер Э., Росс Дж. Российский
хим. журнал. 2000. Т.54. №1. С.34