Сравнительный анализ аминокислотного состава вегетативных побегов различных
видов эфедр Казахстана
Кожамжарова Л.С., Сарбасова Г.А. Найзабаева Г.У.
Методом ионообменной хроматографии проведено сравнительное изучение
аминокислотного состава Ephedra eguisetina Bge. и Ephedra intermedia Schrenk, произрастающих на юге Казахстана. Установлено, что оба исследованных вида характеризуются
высоким содержанием незаменимых аминокислот. Выявлено высокое содержание
фенилаланина, аланина и глютамата, что позволяет предположить их активное участие в биосинтезе метаболистических
предшественников алкалоидов.
Современная картина распространения растительности на
Земном шаре наглядно показывает характерные ее особенности, выражающиеся в
определенной зональности и распределении растений по поясам. Эфедра является
реликтовым растением, сохранившимся с доледниковой эпохи. Поэтому как начальный
и самый примитивный элемент покрытосемянных растений среднего или верхнего
мезозоя, она представляет научный интерес. Этот хвойный кустарничек, любопытен
не только своим древним происхождением, но и тем, что относится к голосеменным.
Эфедра настолько не похожа на других своих родственников, что занимает достаточно
изолированное положение в системе растительного мира и образует отдельное
семейство эфедровых (Ephedraceae). По
последним данным семейство хвойников (эфедровых) на Земном шаре представлено одним родом, насчитывающим
более 67 видов. Свыше 40 видов - в Евразии, Северной Африке, Северной и Южной Америке, преимущественно
в степных, пустынных и горных районах. В странах СНГ произрастает 18 видов, из
них 7 распространены в горных районах Среднеазиатских республик и Казахстана, 4
- в Сибири, 4 - на Кавказе, один в Европейской части и 1- на Дальнем Востоке[1,2]. Флора Казахстана представлена
7 видами рода Ephedra sp. и 2 гибридными
формами [3-6].
Казахстанские
виды рода эфедра представляют собой прекрасный модельный объект как
лекарственные растения для ботанико – географического анализа древнесредиземноморской и ирано-туранской флоры.
Мы располагаем значительным знанием о химической природе и по распространению
эфедриновых алкалоидов в растениях, но сведения о механизме биосинтеза и функции этих низкомолекулярных
соединения в растениях недостаточны[4-10]. В этой связи несомненный интерес представляют данные, позволяющие
выявить связь между первичным метаболизмом и синтезом эфедриновых алкалоидов в
растениях[6-9].
Известно, что аминокислоты являются строительным
материалом для многих высокомолекулярных соединений. Изучение природного соединения обычно протекает в следующей последовательности:
обнаружение - выделение - установление строения. К этим трем основным этапам в
последние годы добавляется изучение биосинтеза. В настоящее время крайне редко
описываются новые соединения без анализа возможных путей их происхождения или
взаимосвязей с другими соединениями.
За последние десятилетие появилась большая серия работ
по исследованию видов рода эфедра флоры
Китая, Америки и Европы [11–15] и прослеживания биосинтеза
эфедриновых алкалоидов по всей биохимической цепочке[16–19], По мнению Taketo Okaka с соавторами эфедриновые алкалоиды синтезируются из аминокислоты
ароматического ряда, фенилаланина в подземных части растения [20].
Настоящая статья посвящена сравнительному изучению
аминокислотного состава у двух
филогенически связанных между собой видов растений рода Ephedra L.- эфедры
хвощевой (Ephedra eguisetina Bge.) и эфедры
промежуточной (Ephedra intermedia Schrenk et C. A. Mey),
произрастающих на юге Казахстана. Методом ионообменной хроматографии проведен анализ
аминокислотного состава свободных и связанных аминокислот эфедры хвощевой (Ephedra eguisetina Bge.) и эфедры
промежуточной (Ephedra intermedia Schrenk). Проведен
сравнительный анализ качественного и количественного аминокислотного состава в
двух популяциях эфедры хвощевой, произрастающих в различных климатических условиях.
Результаты и обсуждение
Широкая
амплитуда морфологической изменчивости, присущая видам, и резкие различия в
окраске отдельных органов в пределах вида, несомненно, связаны с химическими
различиями. Эти различия заставляют углубить химические исследования, и,
возможно, что и в пределах вида удастся вскрыть ряды химических различий
качественного порядка если не в отношении эфирных масел и алкалоидов, то в
отношении других компонентов и, прежде всего белков.
Ранее нами установлено, что в различных популяциях
эфедры хвощевой, климатические условия произрастания влияют на динамику накопления эфедриновых алкалоидов. В условиях южного, более
влагодефицитного биогенеза, количество эфедрина достигало до 2,5 %, наибольшее
резкое снижение алкалоидов отмечено в массивах с большой обеспеченностью влагой [20-26]. В сравнительных условиях мы изучали изменчивость накопления
эфедриновых алкалоидов, белков, ферментов,
бензальдегида и бензойной кислоты в зависимости от видоспецифичности
представителей рода Ephedracea и от их
условий произрастания различных популяций эфедры хвощевой (Ephedra eguisetina Bge.). Более
удачным был анализ состава пероксидазы и полипептидов. По этим маркёрам
показаны достоверные различия между популяциями. У образцов из хребта Джунгарского
Алатау ростовые процессы активнее и в результате суммарное содержание алкалоидов больше, чем у Е.
equisetina из других регионов.
Нами было обнаружено, что
каждая из исследуемых популяций Е. equisetina имеет специфический спектр RAPD – продуктов, характеризующиеся определенным
количеством фрагментов, их размерами и степенью выраженности. Все используемые
праймеры (Pr-3 CCGAATTCGC; Pr-12 CCGGCACGCA; Pr-15 GCCTCGCCCA; Pr-23 GGTGCCGTAC) эффективно обеспечивали синтез специфических и
воспроизводимых наборов ампликонов. Для количественной оценки RAPD - полиморфизма и определения уровня дивергенции между
популяциями были получены матрицы состояния ампликонов, которые обработаны программным пакетом Quantity One-4.1.1 (GelDoc, BioRad) и представлены в виде матрицы состояний бинарных
признаков. Исходя из этой матрицы, невзвешенным парно-групповым кластерным
методом была построена дендрограмма генетического родства между 5 разными
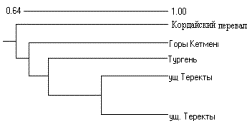
популяциями E. equisetina, рис1.
|
|
|
|||
|
Рисунок 1- Кластерный анализ состояния ампликонов в RAPD-спектрах 5 популяций E. equisetina |
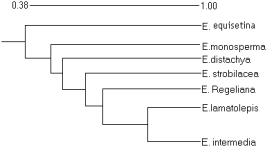
Рисунок 2- Кластерный анализ состояния ампликонов в RAPD-спектрах 7 видов эфедры |
Для определения межвидового полиморфизма были
использованы праймеры Pr-15 и Pr-23. Из полученных ампликонов только два, размером 100
и 350 п.н. являются конститутивными для всех видов эфедры.
Для 4 видов выявлены фрагменты, которые могут
рассматриваться как видоспецифические маркеры. Для E. monosperma
специфическими маркерами являются ампликоны размером 400 и 450 п.н. Наибольшее
число уникальных фрагментов размерами от 120 п.н. до 1100 п.н. выявлены для E.distachya. У вида E.strobilacea
определены два фрагмента размером 130 и 2200 п.н. специфичные для этого вида.
Для E. equisetina
определены три видоспецефичных фрагмента по 150 п.н., 250 п.н. и 3000 п.н.
соответственно,
Настоящая
работа является продолжением систематических биохимических исследований природных
растений рода эфедра Ephedrа
и посвящена изучению аминокислотного
состава. В продолжение работ по
направлению методом ионообменной хроматографии определено содержание
аминокислот в общем пуле связанных и свободных аминокислот в трех образцах
растений. Проведено сравнительное изучение аминокислотного состава двух филогенетически связанных между собой видов
рода Ephedrа - E. equisetina и E.intermedia (рис.2), произрастающих на юге
Казахстана. Также проведен сравнительный
анализ качественного и количественного амино-кислотного состава в двух
популяциях E. equisetina, произрастающих
в различных климатических условиях (рис.1).
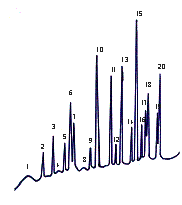
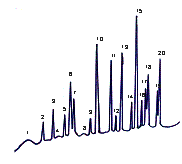
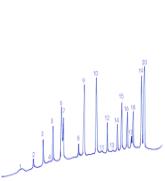
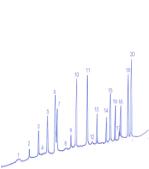
Полученные результаты амино-кислотного состава вегетативных побегов
эфедры исследованы на газовом хроматографе «Карло Эрба» (Италия) и приведены на
рис.3, 4.
|
|
|
|
|
1 |
2 |
3 |
|
1 - E.equisetina,ущелье Теректы, хребет Джунгарский Алатау 2 - E.equisetina, Чу-Илийские горы, Кордайский перевал 3 - E.intermedia, окрестность ст. Жанакорган Рисунок 1- Хроматограмма состава связанных аминокислот
|
||
|
|
|
|
|
1 |
2 |
3 |
|
1 - E.equisetina,ущелье Теректы, хребет Джунгарский Алатау 2 - E.equisetina, Чу-Илийские горы, Кордайский перевал 3 - E.intermedia, окрестность ст. Жанакорган Рисунок 2- Хроматограмма состава свободных
аминокислот |
||
Известно, что скорость
продвижения аминокислот по хроматографической колонке зависит от силы их
электростатических и гидрофобных взаимодействий со смолой. Наиболее прочно
связываются со смолой основные аминокислоты, имеющие наибольший положительный
заряд, наименее прочно – кислые аминокислоты. Наибольшим гидрофобным
связыванием со смолой обладают аминокислоты с неполярными боковыми радикалами,
особенно ароматическими. Порядок
элюирования аминокислот представлен
ниже в таблице.
Таблица - Аминокислотный состав (мг/100 г) в вегетативных побегах различных казахстанских видах рода Ephedra L.
|
№ |
Аминокислотный
состав |
Образцы исследования |
|||||
|
E.equisetina 1 |
E.equisetina2 |
E.intermedia 3 |
|||||
|
свободные амино- кислоты
|
связанные амино- кислоты |
свободные
амино- кислоты
|
связанные амино- кислоты |
свободные
амино- кислоты |
связанные амино- кислоты |
||
|
(1) |
Триптофан |
4,3 |
316 |
3,5 |
324 |
3,2 |
296 |
|
(2) |
Лизин |
2,3 |
126 |
2,1 |
236 |
3,1 |
203 |
|
(3) |
Аргинин |
4,1 |
320 |
3,2 |
334 |
3,4 |
306 |
|
(4) |
Орнитин |
Сл |
12 |
Сл |
8 |
Сл |
10 |
|
(5) |
Гистидин |
7,3 |
130 |
7,2 |
143 |
7,1 |
112 |
|
(6) |
Тирозин |
12,0 |
912 |
11,0 |
883 |
11,0 |
846 |
|
(7) |
Фенилаланин |
7,0 |
628 |
5,6 |
608 |
5,0 |
542 |
|
(8) |
Оксипролин |
Сл |
14 |
1,2 |
10 |
Сл |
12 |
|
(9) |
Цистин |
4,6 |
86 |
4,2 |
68 |
4,2 |
72 |
|
(10) |
Аспартат |
14,0 |
926 |
14,0 |
914 |
13,0 |
893 |
|
(11) |
Серин |
18,0 |
490 |
14,0 |
475 |
16,0 |
469 |
|
(12) |
Метионин |
1,9 |
109 |
1,6 |
86 |
1,6 |
92 |
|
(13) |
Пролин |
6,2 |
716 |
5,1 |
738 |
4,6 |
688 |
|
(14) |
Треонин |
5,0 |
280 |
4,2 |
226 |
3,2 |
243 |
|
(15) |
Глютаминат |
12,0 |
1920 |
13 |
1942 |
14,0 |
1714 |
|
(16) |
Валин |
8,2 |
368 |
7,3 |
350 |
6,5 |
336 |
|
(17) |
Изолейцин |
3,0 |
265 |
2,7 |
218 |
2,2 |
223 |
|
(18) |
Лейцин |
6,3 |
502 |
6,2 |
470 |
5,8 |
490 |
|
(19) |
Глицин |
18,0 |
329 |
16,0 |
313 |
16,0 |
292 |
|
(20) |
Аланин |
22,0 |
975 |
18,0 |
946 |
19,0 |
920 |
|
Примечание: 1 - Ущелье Теректы, хребет Джунгарский Алатау, образец 1 (влагодефицитная зона) 2 - Чу-Илийские горы, Кордайский перевал, образец 2 3 - окрестность ст. Жанакорган,
Кзылординская обл., образец 3 |
|||||||
.При
сравнении аминокислотного состава популяций E. equisetina
установлено, что климатические условия произрастания растения существенно не
влияют на качественный состав аминокислот.
Из сравнения аминокислотного состава E. equisetina и E. intermedia следует, что общее содержание
аминокислот выше у E. equisetina. Однако качественный аминокислотный состав вегетативных побегов
исследованных образцов в основном сходен.
Как видно из табличных данных набор аминокислот
разнообразен, которые различаются по
строению заместителей в боковой цепи (алифатические, ароматические и гетероциклические) и по
числу аминных и карбоксильных групп. В
исследуемых образцах методом ионнообменной хроматографии было идентифицировано
20 аминокислот, 10 из которых относятся к ряду незаменимых. Спектр незаменимых кислот в
надземной части растений представлен следующими аминокислотами: валин,
изолейцин, лейцин, треонин, метионин, лизин, фенилалании, триптафан, аргинин,
гистидин. При этом выявленный уровень
фенилаланина во всех видах эфедры может указывать на его активное участие в
процессах вторичного метаболизма эфедриновых алкалоидов. В вегетативных побегах
исследуемых образцах незаменимые аминокислот составляют 50% от
суммы учтенных аминокислот. К заменимым
аминокислоты отнесены глицин, аланин, серин,
орнитин, пролин, аспартат, глутаминат,
цистин и тирозин. Свободные заменимые аминокислоты, за исключением оксипролина
и орнитина, найдены в двух популяциях E.equisetina и филогенетически связанной с ней видом - E.intermedia (табл.). Сведения о содержании первичных аминокислот:
аланина и производных аспарагиновой и
глутаминовой кислот также могут дать важную информацию о наличии связи между
первичным и вторичным метаболизмом.
Сравнивая полученные результаты по качественному и количественному содержанию аминокислот (табл.), исследуемые образцы можно расположить в следующем ряду E.equisetina, образец 1>E.equisetina,образец 2 > E.intermedia. Климатические условия произрастания оказались значимым фактором, влияющим на количественное содержание свободных аминокислот в различных популяциях E. equisetina, но не на качественный состав аминокислот. Экологические условия не оказывают существенное влияние на состав связанных аминокислот. Различия по составу аминокислот растений cемейства Ephedraceae из разных экологических зон Казахстана более связаны с их географическим происхождением, чем с систематическим положением. Более того, не наблюдается значительного накопления аминокислот в вегетативных побегах эфедры, что согласуется с утверждением Taketo Okado, Masayuki Mikage and Setsuko Sekita о синтезе эфедринов в надземной и подземной частях растения, т.е. на основания литературных данных и по нашим исследованиям установлено, что местом локализации синтеза алкалоидов является не только надземная часть, но и всё растение. Стремление учесть генезис растительных конституентов помогает понять, гомологичны они или аналогичны, и сделать соответствующие выводы. Выявление фенотипической специфичности вида, особенностей морфологических, физиолого-биохимических, фитохими-ческих, дает возможность определить механизмы адаптации вида к конкретным условиям произрастания.
Материалы и методы. Объектами исследования являются эфедра хвощевая (Е.equisentina Bge.), которые
собирали в Алматинской (Ущелье Теректы, хребет Джунгарский Алатау, образец 1),
Жамбылской (Кордайском район, Чу-Илийские горы, Кордайский перевал, образец 2)
в областях на каменистых склонах гор. И
E.intermedia (окрестность ст. Жанакорган, Кзылординская
область, образец 3).
Методика определения связанных аминокислот. 1,0 г образца гидролизовали в 5 мл 6 Н HCl
при температуре 105ºС в ампулах, запаянных под аргоном в
течение 24 ч, полученный гидролизатора трижды выпаривали на ротарном испарителе при tº
– 40ºС и полученный осадок растворяли в 5 мл 5% сульфосалициловой кислоты. После центрифугирования надосадочную
жидкость пропускали через колонку с Даукс-50, н – 8, 200 – 400 мн со скоростью
1 капля в секунду. В начале смола промывалась 1 – 2 мл снова деионизированной
водой до нейтральной рН. Для элюирования аминокислот через колонку пропускали 3
мл 6 Н раствора NH4 со скоростью 2 капли в секунду. Элюат собирался в круглодонную колбу
вместе с деионизированной водой, которую использовали для отмывания колонки до
нейтральной рН. Содержимое колбы досуха выпаривали на роторном испарителе под
давлением 1 атм и температуре 50 – 60ºС.
После добавления в колбу 1 капли
свежеприготовленного l,5% SnCl2, 1 капли 2,2 – диметоксипропана и
1 – 2 мл насыщенного НСl пропанола, ее нагревают до 110º С,
выдерживая эту температуру в течение 20 мин, а затем содержимое колбы вновь
выпаривают на роторном испарителе. Следующим этапом было внесение в колбу1 мл
свежеприготовленного ацелирующего реактива (1 объем уксусного ангидрида, 2
объема триэтиламина, 5 объемов ацетона), нагревание при температуре 60˚
С в течение 1,5 – 2 мин и выпаривание образца досуха, добавление в нее 2
мл этилацетата и 1 мл насыщенного раствора NaCl. Содержимое колбы тщательно
перемешивают и по мере того, как
образуется два слоя жидкостей – берут верхний (этилацетатный) для
газохорматографического анализа, который проводили на газовом хроматографе «Карло
Эрба» (Италия).
Условия хроматографирования:
Температура пламенно –
ионизационного детектора 300ºС
Температура испарителя 250ºС
Начальная температура колонки (печи) 110˚С
Конечная температура колонки 250˚С
Скорость программирования
температуры колонки : от 110ºС до 185ºС – 6º
в мин; от 185º до 250º – 32˚
в мин. При достиженнии температуры колонки 250º она должна сохраняться
до полного выхода всех аминокислот.
Для разделения аминокислот
использовалась колонка из нержавеющей стали, размером 400х3 мм, заполненная
полярной смесью из 0,31% карбовакса 20 м, 0,28% силара 5 ср и 0,06% гексана на
хромосорбе WA – W – 120 – 140 меш.
Статистическая обработка
материалов проводилась на ЭВМ ДКВ – 3.
Методика определения свободных аминокислот. К 1,0 г образца добавлялось 5
мл 5% сульфосалициловой кислоты. После центрифугирования при 2,5 т
об/мин в течение 15 мин брали надосадочную жидкость и пропускали через
ионообменную колонку с Даукс -50, н – 8, 200 – 400 мн со скоростью 1 капля в
секунду. В начале смола промывалась 1 – 2 мл снова деионизированной водой до
нейтральной рН. Для элюирования аминокислот через колонку пропускали 3 мл 6 Н
раствора аммиака со скоростью 2 капли в секунду. Элюат собирался в круглодонную
колбу вместе с деионизированной водой, которую использовали для отмывания
колонки до нейтральной рН. Содержимое колбы досуха выпаривали на роторном
испарителе под давлением 1 атм и при температуре
50 – 60ºС.
После добавления в колбу 1 капли
свежеприготовленного l,5% SnCl2, 1 капли 2,2 – диметоксипропана и
1 – 2 мл насыщенного НСl, пропанола, ее нагревают до 110º С,
выдерживая эту температуру в течение 20 мин, а затем содержимое колбы вновь
выпаривают на роторном испарителе. Следующим этапом было внесение в колбу 1 мл
свежеприготовленного ацелирующего реактива (1 объем уксусного ангидрида, 2
объема триэтиламина, 5 объемов ацетона), нагревание при температуре 60˚
С в течение 1,5 – 2 мин и выпаривание образца досуха, добавление в нее 2
мл этилацетата и 1 мл насыщенного раствора NaCl. Содержимое колбы тщательно
перемешивают и по мере того, как
образуется два слоя жидкостей – берут верхний (этилацетатный) для газохроматографического
анализа, который проводили на газовом хроматографе «Карло Эрба» (Италия).
Условия хроматографирования:
Температура пламенно – ионизационного
детектора 300ºС
Температура испарителя 250ºС
Начальная температура колонки (печи) 110ºС
Конечная температура колонки 250ºС
Скорость программ – 32º
в мин. При достиженнии температуры колонки 250˚ она должна сохраняться
до полного выхода всех аминокислот.
Для разделения аминокислот
использовалась колонка из нержавеющей стали, размером 400х3 мм, заполненная
полярной смесью из 0,31% карбовакса 20м, 0,28% силара 5 ср и 0,06% гексана на
хромосорбе WA – W – 120 – 140 меш.
Статистическая обработка материалов
проводилась на ЭВМ ДКВ – 3.
Для разделения аминокислот
методом ионообменной хроматографии используют катионообменные смолы. Процесс
ведут в кислой среде, когда аминокислоты находятся катионной форме.
Выводы
При сравнении аминокислотного состава популяций E. equisetina установлено, что климатические условия произрастания
растения существенно не влияют на качественный состав аминокислот. Из сравнения аминокислотного состава E. equisetina и E. intermedia следует, что общее содержание аминокислот выше у E. equisetina. Однако качественный аминокислотный состав вегетативных побегов
исследованных образцов в основном сходен. Более того, не наблюдается
значительного накопления аминокислот в вегетативных побегах эфедры, что
согласуется с утверждением Taketo
Okado, Masayuki
Mikage and Setsuko Sekita о синтезе эфедринов в надземной и подземной частях
растения [20], т.е. на основания литературных данных
и по нашим исследованиям установлено, что местом локализации синтеза алкалоидов является не только
надземная часть, но и всё растение.
Таким
образом, изучен химический состав вегетативных побегов у популяций
казахстанских видов эфедры. Применённые методы исследования: хроматографии, RAPD-метод, изозимный и
белковый анализ позволили установить, что их качественный и количественный
состав зависят от условий произрастания и генетических особенностей.
Библиография
1
Caveney S., Charter D.A., Freitag H.M.
Maier-Stolte, Starratt A.N. New observation on the secondary
chemistry of world Ephedra (Ephedraceae)
//American J. of Botany. 2001. V. 88. P. 1199-1208.
2 Род хвойник - Ephedra L. Флора Казахстана.Алма-Ата:«Наука»,1956.Т.1. С. 76.
3 Флора СССР, Изд-во. АН СССР. М.–Л., 1961.- Т. 1.- С. 263.
4 Егеубаева Р.А., Бижанова Г.К., Айдарбаева Д.К., Кузьмин Э.В. Распространения и запасы эфедры хвощевой в Алматинской области //Тр. Гос. Нац. Природн. Парка «Алтын-Эмель». 2006. Вып. 1. С. 62-66.
5 Атылыкова Ф.М., Кукенов М.К. Эфедра хвощевая и современное состояние ее популяций в Казахстане //Изв. НАН РК. 1995. № 4. С. 3-7.
6
Клышов Л.К., Алюкина Л.С.
Биолого-экологическая характеристика некоторых видов эфедры //В кн.: Материалы
по физиологии и биохимии растений/ Тр. Ин-та ботаники АН КазССР. 1962. Т. XII. С. 206.
7 Клышев Л.К., Алюкина Л.С. Биохимия эфедры //Лекарственные растения Казахстана: тр. Ин-та ботаники АН КазССР. Алма-Ата. 1966. Т. XXII. С.33-72.
8
Алюкина Л.С., Клышев Л.К., Кунаева Р.К. К вопросу изучения эфедры в Казахстане //Изв. АН КазССР, сер. ботаники и
почвоведения. 1960. № 7, Вып. 1. С.33-46.
9 Ергожин Е.Е., Джиембаев Б.Ж., Барамысова Г.Т. Научное наследие академика М.И. Горяева. Алматы: Эверо, 2004. 540 с.
10 Журинов М.Ж., Газалиев А.М., Фазылов С.Д. Химия эфедриновых алкалоидов. - Алма-Ата: Наука КазССР, 1990. – С. 140.
11
Maged S. Abdel-Kader, Fahima F. Kassem, Rokia M. Abdallah Two
alkaloids from Е.aphylla growing in Egypt/ J.Natural Product Sciences.
2003.9(2). P.1-4.
12
Lishi
Wang, Daqing Zhao, Yonghong Liu. GC-MS analysis of the supercritical CO2 fluid extraction of Ephedra sinaca roots and its
antisudorific activity //Химия природ. соедин. 2009. № 3. С. 366, 367.
13 F. Maggi, M. Nicoletti, G. Sagratini, F. Papa, S.Vittori. Microexaction
(SPME) analysis of six Italian populations of Epedra nebrodensis Tineo ex
Guss.subsp. nebrodensis //Chemistry&Diodiversity.2011.V.8. P.95-114.
14 Liu Y.M., Sheu S.J., Chiou S.H., Chang H.C., Chen Y.P. A comparative study of commercial
samples of ephedrae herba// Planta Medica. 1993.59 (4). Р.376-378.
15 Abourashed E.A., El-Alfy A.T., Khan I.A., Walker L. Ephedra
in perspective - a current review// Phytotherapy Research.2003.17 (7).P. 703-712.
16
Gunnar Grue-Sorensen and Jan D. Spenser. The biosynthesis of ephedrine
//Can. J. Chem. 1989.V. 67. P. 998–1009.
17
Gunnar Grue-Sorensen and Jan D. Spenser. The biosynthesis of ephedrine //J. Am. Chem. Soc. 1988.V. 110. P. 3714–3715.
18
Gunnar
Grue-Sorensen and Jan D. Spenser. Biosynthetis Route to Ephedrine Alkaloids: Evolution of the С6-С1 Skeleton //J. Am. Chem. Soc. 1993. V. 115.P. 2052–2054.
19
Gunnar
Grue-Sorensen and Jan D. Spenser. Biosynthetis Route to Ephedrine
Alkaloids //J. Am. Chem. Soc. 1994.V. 116. P. 6195–6200.
20
Taketo
Okaka, Masayuki Mikage,Setsuko Sekita. Molecular characterization of phenulalanine
ammonialyase from Ephedra sinica//Biol.Pharm.Bull.2008.V.32(12).P.2199–2199.
21 Барамысова Г.Т. Биосинтез и метаболизм
фенилалкиламинов //Хим. ж. Казахстана. 2009.
№ 3 . С. 25–44.
22
Baramysova, G.T., Kozhamjarova L.S., Sarsenbaev,
K.N., Dzhiembaev, B.Zh., Butin B.M.A Study on Quantitative Composition of
Ephedrine-Derivative Alkaloids in Some Ephedra eguisetina Bunge Populations//Abstracts 6th International Symposium on
The Chemistry of Natural Compounds «Chemistry, Pharmacjlogy and biosynthesis
of Alkaloids», 28-29
June 2005 – Antalya. Р. 73.
23
Baramisova G.T., Djiembaev B.J., Kozhamzharova L. S., Sarsenbaev .N., Chemosystematics of population
of Кazakhstan’s species
of EPHEDRA L.// 9-th. International Sуmposium on the Chemistrу of Natural Compounds.- October 16-18, 2011,Urumgi.- Р.69.
24
Кожамжарова Л.С., Сарсенбаев К.Н., Барамысова Г.Т. Популяционный полиморфизм эфедры
хвощевой //Вестник КазНУ Серия биологическая. 2006. № 1 (27). С. 7-14.
25 Кожамжарова Л.С., Сарсенбаев К.Н., Барамысова Г.Т., Джиембаев Б.Ж. Морфологические и биохимические особенности популяций эфедры хвощевой, произрастающих в различных регионах Казахстана //Химический журнал Казахстана. 2006. № 2.C. 172-177.
26 Кожамжарова Л.С., Сарсенбаев К.Н., Барамысова Г.Т., Джиембаев Б.Ж. Эфедра Казахстана: морфологические и биохимические, экологические особенности //Исследование, разработка и применение высоких технологий в промышленности: Сб. тр. Третьей междунар. научно-практ. конф. Санкт-Петербург. 2007.Т. 9. С. 205.