Писаненко
Д.А.1, Палий Г.К.2
1 Национальный
технический университет Украины «Киевский политехнический институт»
2 Винницкий
государственный медицинский университет им. Н. И. Пирогова
Антимикробные свойства замещенных циклопентилфенолов
Известно,
что фенольные соединения как синтетические [1], так и растительного
происхождения [2, 3] представляют интерес для фармакологии как малотоксичные
бактерициды и биологические антиоксиданты [4]. Биологическое действие фенолов
связывают с их способностью влиять на клеточную стенку микроорганизмов, образуя
комплекcные соединения с полисахаридами и коагулируя белки
[5]. Введение в структуру фенолов атомов галогенов и циклических фрагментов
может влиять их способность к
проницаемость клеточной стенки и, соответственно, на биологические свойства фенолов [6].
Проведенные исследования по изучению таких свойств в ряду фенолов с
циклопентильными заместителями показали возможность использования некоторых из
них в качестве инсектицидов [7] и дезинфектантов [8]. В связи с этим представляет
интерес дальнейшее изучение влияния структуры замещенных циклопентилфенолов на
их антимикробные свойства. Для этого в
настоящей работе был синтезирован ряд замещенных циклопентилфенолов общей
формулы:
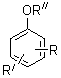 где I – VII R=цикло-С5Н9;
I 2-R, R’=H, R’’=H;
где I – VII R=цикло-С5Н9;
I 2-R, R’=H, R’’=H;
II 4-R, R’=H, R’’=H; III 2–R, R’=4-Cl, R’’=H;
IV 4-R, R’=2-Cl, R’’=H; V 2-R, R’=4-F, R’’=Me;
VI 4-R, R’=2-Cl, R’’=Me, VII 4-R, R’=2-Br,
R’’=Me;
VIII R=4-(3-C6H5цикло-C5H9), R’=H, R’’=H;
IX R=4-[3-(4-MeOC6H4цикло-С5H9]; R’=H,
R’’=H;
X R=4-[3-(4-EtoC6H4цикло-C5H9], R’=H, R’’=H.
и изучена их антимикробная активность по отношению к
грамположительным, грамотрицательным, спорообразующим, капсульным бактериям и
дрожжеподобным грибам.
Смесь
фенолов (I–II) получали с выходом 70% при алкилировании фенола
циклопентанолом в присутствии H3PO4 [9] с
последующей ректификацией и выделением индивидуальных фенолов I и II при контроле
их чистоты с помощью ГЖХ. Хлорзамещенные циклопентилфенолы (II–IV)
синтезировали деметилированием соответствующих хлорциклопентиланизолов в смеси
48%HBr и уксусного ангидрида [10]. Хроматографически чистые
изомеры (V–VII) получены перегонкой продуктов реакции 4-фтор-,
2-бром- и хлоранизолов с циклопентеном в присутствии BF3·H3PO4 [10, 11]. Фенол (VIII)был выделен из продуктов реакции фенола с
3-фенилциклопентеном в присутствии катализатора BF3·H3PO4 [12], а фенолы (IX-X) получали
гидрированием над Ni – Ренея соответствующих
1,4-диарил-1,3-циклопентадиенов, образующихся при взаимодействии
3-(4-алкоксифенил)циклопентенов с фенолом в присутствии этого же катализатора
[13]. Индивидуальность фенолов (I-X) проверяли с помощью ГЖХ (цвет – 102, колонка
1000×3 мм, 5% анизона L на носителе Inerton N-AW-HMDS,
газ-носитель – гелий), строение подтверждено соответствием их физико-химических
констант литературным и спектральными данными. ИК-Спектры регистрировали на
приборе Specord-75-JR, спектры ПМР
– на спектрометре JEOL (90 МГц) в DMCO-d6.
Антимикробную
активность синтезированных фенолов изучали методом последовательных разведений
в жидкой питательной среде, для приготовления растворов веществ использовали
диметилсульфоксид [14]. Тест-объектами были грамположительные (S.aureus, S.viridans),
грамотрицательные (E.coli, Sh.flexneri, Salm.typhi, Salm.typhimurium, B.proteus vulgaris,
Ps.aueruginosa),
спорообразующие (Bac.antracoides, Bac.subtiles), капсульные (K.rhinoscleuromatis)
бактерии и дрожжеподобный гриб (C.albicans). Для сравнения влияния структуры на антимикробные
свойства изучали отношение этих микроорганизмов к 2-хлорфенолу (XI). Результаты исследования антимикробной активности
фенолов (I-XI) приведены в таблице.
Как
видим из таблицы, все изученные циклопентилзамещенные фенолы (II, IV, VIII-X) обладают достаточно
сильным антимикробным действием по отношению ко всем тест-объектам. Введение
атома хлора в их структуры и увеличение объемности циклопентильного радикала
повышает их антимикробную активность, а перевод гидроксильных групп в
алкоксигруппы заметно снижает ее (V-VII). Присутствие циклопентильного заместителя в
структуре фенола (IV) повышает его активность по
отношению к грамположительным и грамотрицательным бактериям в сравнении с
незамещенным 2-хлорфенолом (XI). Проведенное
исследование бактерицидных свойств фенолов (I-XI) показало,
что для достижения гибели микроорганизмов под воздействием этих фенолов
необходимо увеличение минимальной бактериостатической концентрации для
большинства фенолов (I-XI) только в 1,5 – 2 раза.