Химия и химические технологии/5.
Фундаментальные проблемы создания новых материалов и технологий
К.х.н. Шачнева Е.Ю., Магомедова Э.М., Зухайраева А.С.
Астраханский государственный
университет, Россия
ИЗУЧЕНИЕ
АДСОРБЦИИ МЕДИ И ЦИНКА ИЗ ВОДНЫХ
РАСТВОРОВ
АКТИВНЫМИ УГЛЯМИ
Целью работы явилось изучение адсорбции тяжелых металлов на активных
углях, в ходе исследований получены изотермы статической сорбции веществ из
водных растворов, рассчитаны основные термодинамические характеристики сорбции.
Результаты
проделанной работы могут быть использованы для очистки воды от тяжелых
металлов [1-7].
Получение данных для построения
градуировочного графика. В серию из
10 пробирок объемом 20 см3 вносили 0; 0,1; 0,2; 0,5; 1,0; 1,5; 2,0;
2,5; 3,0; 5,0 см3 раствора соли металла с концентрацией 1·10-3 М,
к раствору прибавляли по 4 см3 раствора органического реагента ПАР
(4-(2-пиридилазо)резорцина) с концентрацией 1·10-3 М и доводили
объемы растворов дистиллированной водой до 20 см3. Полученные
растворы перемешивали и измеряли оптические плотности растворов при 530 нм в
кювете толщиной 0,5 см относительно воды. По результатам измерений стоили
градуировочные графики.
Изучение адсорбции ионов меди, цинка на
активных углях. В серию из 10 пробирок объемом 10
см3 вносили 0; 0,1; 0,2; 0,5; 1,0; 1,5; 2,0; 2,5; 3,0; 5,0 см3
раствора соли металла с концентрацией 1·10-3 М, прибавляли
необходимое количество дистиллированной воды (до 10 см3). В полученный
раствор вносили по 0,2 г активного угля, встряхивали 3 мин, отстаивали,
центрифугировали при 3000 об./мин в течении 10 минут. Полученные после
центрифугирования растворы сливали, в полученные растворы вносили по 4 см3
раствора органического реагента ПАР и доводили объем растворов до 20 см3.
Полученные растворы перемешивали и измеряли оптические плотности растворов при
530 нм в кювете толщиной 0,5 см относительно воды. Опыты проводили при 277,
298, 313 К.
Строили графические зависимости оптической
плотности от концентрации металла. На основании градуировочного графика, с
использованием результатов опытов, определяли равновесные концентрации
исследуемых веществ. Строили изотермы сорбции в координатах «сорбция (Г) -
равновесная концентрация [c]». Сорбцию (Г)
рассчитывали по уравнению (1):
![]() (1)
(1)
где С0 –
исходная концентрация сорбата, моль/дм3; V – объем исследуемого раствора, см3; [С] – остаточная (равновесная)
концентрация сорбата, моль/дм3; M – молярная (или атомная) масса сорбата, моль/дм3;
m – масса активного угля, г.
Изотермы сорбции были перерасчитаны в
изотермы уравнения Ленгмюра, а с их использованием были рассчитаны константы
сорбции (К) и величина предельной сорбции (Г∞) при 277, 298 и
313 К.
По величинам констант
сорбции были рассчитаны изменение энтальпии (∆Н) и
изобарно-изотермического потенциала (∆G), а с их использованием были рассчитаны значения
изменения энтропии (∆S) (2-4):
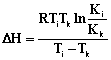 (2)
(2)
![]() (3)
(3)
![]() (4)
(4)
Результаты опытов и расчетов приведены в
табл.1.
Таблица 1
Основные характеристики адсорбции меди и
цинка на активном угле (n=6, tp=0,95, S=2,57)
|
Определяемая характеристика |
Температура, К |
Металлы |
|
|
Cu (II) |
Zn (II) |
||
|
Константы сорбции · 10-3 |
277 |
0,21 |
0,16 |
|
298 |
0,24 |
0,17 |
|
|
313 |
0,39 |
0,19 |
|
|
-ΔG, кДж/моль |
277 |
28,36 |
26,92 |
|
298 |
29,63 |
29,30 |
|
|
313 |
35,67 |
31,44 |
|
|
-ΔH, кДж/моль |
1,83 |
2,06 |
|
|
-ΔS, Дж·моль/К |
277 |
95,77 |
89,74 |
|
298 |
98,79 |
91,42 |
|
|
313 |
108,12 |
93,86 |
|
|
Емкость сорбента (Г∞), мг/г |
277 |
3,33 |
3,60 |
|
298 |
5,00 |
4,80 |
|
|
313 |
10,00 |
6,70 |
|
Анализ полученных результатов позволяет сделать заключение о том, что
сорбция ионов металлов на активных углях идет достаточно активно. Величины
изменения изобарно-изотермического потенциала свидетельствуют о самопроизвольном
характере процесса сорбции. Полученные результаты позволяют считать, что
происходит образование прочных адсорбционных комплексов, при этом емкость углей
по отношению к тяжелым токсичным металлам достаточно высока, что позволяет
извлекать из воды достаточно большие количества металлов.
Результаты очистки
воды от ионов меди, цинка с использованием активных углей. Были проведены опыты по очистке воды от ионов металлов.
Загрязнители вносили в исходную воду в количествах, указанных в табл. 2.
Эффективность очистки рассчитывалась по формуле (5):
![]() , (5)
, (5)
где Э – эффективность очистки, %; С0 – исходная концентрация,
моль/дм3; С – остаточная
концентрация, моль/дм3.
Результаты расчетов эффективности очистки воды от
ионов металлов активными углями приведены в табл. 2.
Таблица 2
Эффективность очистки воды от ионов меди
и цинка активными углями (n=6, tp=0,95, S=2,57)
|
Металл |
Исходная концентрация·104, моль/дм3 |
Концентрация после сорбции · 104, моль/дм3 |
Эффективность очистки, % |
||||
|
Температура, К |
|||||||
|
277 |
298 |
313 |
277 |
298 |
313 |
||
|
Cu (II) |
0,00 |
0,00 |
0,00 |
0,00 |
0,00 |
0,00 |
0,00 |
|
0,05 |
0,01 |
0,01 |
0,01 |
80,00 |
80,00 |
80,00 |
|
|
0,10 |
0,03 |
0,02 |
0,01 |
70,00 |
80,00 |
90,00 |
|
|
0,25 |
0,10 |
0,09 |
0,01 |
60,00 |
64,00 |
96,00 |
|
|
0,50 |
0,28 |
0,15 |
0,02 |
44,00 |
70,00 |
96,00 |
|
|
0,75 |
0,52 |
0,25 |
0,05 |
30,67 |
66,67 |
93,33 |
|
|
1,00 |
0,70 |
0,40 |
0,07 |
30,00 |
60,00 |
93,00 |
|
|
1,25 |
0,85 |
0,60 |
0,08 |
32,00 |
52,00 |
93,60 |
|
|
1,50 |
0,88 |
0,72 |
0,12 |
41,33 |
52,00 |
92,00 |
|
|
2,50 |
0,98 |
0,82 |
0,51 |
60,80 |
67,20 |
79,60 |
|
|
Zn (II) |
0,00 |
0,00 |
0,00 |
0,00 |
0,00 |
0,00 |
0,00 |
|
0,05 |
0,03 |
0,02 |
0,015 |
40,00 |
60,00 |
70,00 |
|
|
0,10 |
0,06 |
0,05 |
0,05 |
40,00 |
50,00 |
50,00 |
|
|
0,25 |
0,19 |
0,15 |
0,12 |
24,00 |
40,00 |
52,00 |
|
|
0,50 |
0,32 |
0,3 |
0,22 |
36,00 |
40,00 |
56,00 |
|
|
0,75 |
0,39 |
0,35 |
0,32 |
48,00 |
53,33 |
57,33 |
|
|
1,00 |
0,41 |
0,38 |
0,35 |
59,00 |
62,00 |
65,00 |
|
|
1,25 |
0,43 |
0,40 |
0,38 |
65,60 |
68,00 |
69,60 |
|
|
1,50 |
0,47 |
0,41 |
0,39 |
68,67 |
72,67 |
74,00 |
|
|
2,50 |
0,50 |
0,45 |
0,41 |
80,00 |
82,00 |
83,60 |
|
Таким образом, можно сделать вывод о том,
что активные угли можно использовать для сорбционной очистки воды от тяжелых
токсичных металлов. Как видно из данных табл. 2, они достаточно эффективно
удаляют ионы металлов из водных растворов со степенью очистки до 96%.
Литература
1. Шачнева, Е.Ю. Воздействие ионов цинка и
меди на окружающую среду [Текст] / Е.Ю. Шачнева, Н.М. Алыков, А.С. Зухайраева,
Э.М. Магомедова // «Научное творчество XXI века»: VI Межд. научн.-практ. конф. – Красноярск. – 2012.
2.
Алексеев, Ю.В. Тяжелые
металлы в почвах и растениях [Текст] / Ю.В. Алексеев // Л.: Агропромиздат. -
1987. – 142 с.
3.
Алыков, Н.М. Природные
ископаемые ресурсы и экологические проблемы Астраханского края [Текст] / Н.М.
Алыков, Н.Н. Алыков и др. // Под ред. Н.М. Алыкова. - Астрахань: Изд. дом
«Астраханский университет». - 2005. –
113 с.
4.
Бандман, А.Л. Вредные
химические вещества. Неорганические соединения элементов I–IV групп [Текст] /
А.Л. Бандман, Г.А. Гудзовский, Л.С. Дубейковская и др. // Л.: Химия. - 1988. –
512 с.
5.
Грушко, Я.М. Вредные
неорганические соединения в промышленных сточных водах [Текст] / Я.М. Грушко //
Л.: Химия, 1979. – 160 с.
6.
Химия промышленных
сточных вод [Текст] / Под ред. А. Рубина // М.: Химия. - 1983. - 360 с.
7.
Алыков Н.М., Алыкова
Т.В. и др. Химия и окружающая среда [Текст] / Учебн. пособие для ВУЗов. Астрахань:
Изд-во Астрах. гос. ун-та. - 2003. – 175 с, 25 таб.