Медицина/7
студ. Фомина М.А., студ. Штейнгауэр Н.Н., м.н.с. Петрова Н.В.,
д.т.н., проф. Родионов И.В., к.т.н., доц. Фомин А.А.
Саратовский государственный технический университет
имени Гагарина Ю.А., Россия
Статья подготовлена при финансовой поддержке Минобрнауки РФ в рамках ФЦП «Научные и научно-педагогические кадры инновационной России» на 2009–2013 годы, соглашение № 14.B37.21.0571.
Биоактивное покрытие TiO2 на медицинских изделиях из технически чистого титана, модифицированное
наночастицами кальций-фосфатной керамики
Введение
Титан и его
сплавы (ВТ1-00, ВТ16 и др.) часто используются при изготовлении различных
чрескостных ортопедических конструкций и внутрикостных стоматологических систем
[1]. Модифицирующая обработка поверхности такого вида медицинских изделий
обычно проводится плазменным напылением, вакуумно-конденсационными методами
осаждения (PVD, CVD) и оксидированием [2, 3]. Отличительными чертами
данных методов является большая энергоемкость и стоимость используемых
материалов, низкий коэффициент использования материала для покрытия, сложная
технологическая последовательность, относительно большая продолжительность
процесса получения необходимого фазово-структурного состояния, сниженная
механическая прочность при высоких значениях пористости, а также ограниченность
или отсутствие возможности образования наноструктуры. Хорошо известны
исследования Кофстада П., Лайнера Д.И., Войтовича Р.Ф., в которых исследуются
процессы и закономерности окисления тугоплавких металлов, в том числе
технически чистого титана (ВТ1-00, ВТ1-0). Современные исследования касаются
изучения кинетики образования оксидных покрытий в изотермических условиях [4].
Остается открытой проблема получения на поверхности медицинских металлических
материалов механически прочных покрытий, характеризуемых высокими качествами
биосовместимости при функционировании в организме. В связи с вышеуказанным целью данной работы является разработка
технологии формирования биоактивных и прочных покрытий с развитой морфологией
за счет использования метода индукционно-термической обработки (ИТО) и
модификации наночастицами
кальций-фосфатной керамики на основе гидроксиапатита (ГА).
Методика эксперимента
Образцы представляют пластины технически чистого титана ВТ1-00 толщиной 2 мм, поверхность которых подвергается пескоструйной обработке корундом, травлению в растворе плавиковой и азотной кислот, а также ультразвуковой очистке. Поверхность подготовленных образцов оксидируется на воздухе при воздействии ТВЧ, далее производятся модификация наночастицами ГА и завершающая индукционно-термическая обработка (ИТО). Устанавливается влияние ИТО в диапазоне температур 600…1200 °C на показатели структуры получаемых покрытий, а также на твердость. При этом используются растровая электронная микроскопия (РЭМ) и наноиндентирование с нагрузкой не более 10 мН, прикладываемой к алмазному индентору Берковича (ISO 14577, ASTM E 2546). Проверка биосовместимости проводится in vitro на клетках (фибробластах) человека. Образцы покрытий нумеруются в соответствии с величиной температуры ИТО, например, 06 – 600 °C, 12 – 1200 °C.
Результаты исследования и их анализ
Результаты РЭМ поверхности образцов показали
наличие пористой металлооксидной матричной структуры, модифицированной
наночастицами ГА (рис. 1).

Рис. 1. Морфология микро- (a) и наноструктуры (b) покрытия,
полученного при режиме ИТО 08
Микроструктура поверхности представляет
собой рельеф исходной металлической основы после подготовительных операций и
оксидирования (рис. 1 a). Исследование в
нанометровом масштабе позволяет выявить тонкую структуру, представленную
округлыми зернами, их агломератами и мельчайшими порами (рис. 1 b). Каркас такой структуры образует металлооксидная матрица, в поры
которой внедряются наночастицы ГА. При этом поверхностный слой субмикрометровых
и микрометровых выступов, а также пор равномерно покрыт тончайшим слоем
наночастиц ГА средним размером 30…50 нм, образующихся при режимах 06 и 08.
Увеличение температуры ИТО способствует их коалесценции с образованием слоистой
пористой структуры.
Твердость в нанометровом масштабе исследования при режиме ИТО 06 характеризуется трехкратным возрастанием до 6 ГПа по сравнению с титановой основой. При режиме ИТО 08 и 12 твердость достигает максимальных значений и составляет 15…16 ГПа. Модуль упругости образцов покрытий, полученных при режиме ИТО 06 несколько ниже, чем у титана, однако при режимах ИТО 08 и 12 происходит его увеличение до 173…234 ГПа (табл.).
Таблица
Механические
свойства биоактивных покрытий
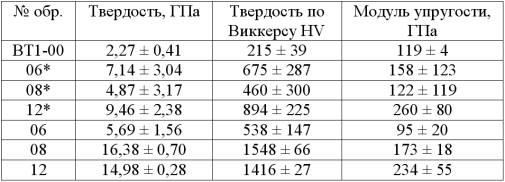
* – металлооксидное покрытие без наночастиц ГА
биокерамики [5]
Проверка биосовместимости in vitro получаемых образцов покрытий показала, что высокая морфологическая гетерогенность поверхностной структуры обеспечивает стабильную адгезию фибробластов, в том числе за счет внедрения клееподобного вещества в мельчайшие поры (рис. 2).
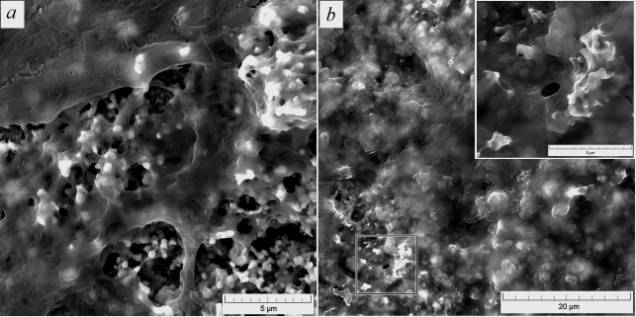
Рис. 2. Морфология
поверхности покрытия, полученного при режиме ИТО 08, после теста in vitro в течение 2 (a) и 4 (b) недель
Прикрепление клеток происходит наиболее активно в присутствии нанометровых структур, при этом развитая морфология покрытий, полученных при режимах ИТО 08 и 12, активно стимулирует процесс биоинтеграции.
Вывод
Обработка ТВЧ и последующее модифицирование при воздействии ИТО титановых медицинских изделий обеспечивает ускоренное образование на их поверхности механически прочной структуры, состоящей из пористой металлооксидной матрицы и наночастиц ГА. Установлено, что тонкослойное металлооксидное покрытие, модифицированное наночастицами ГА керамики, формируемое при нагреве от 800 до 1200 °C и выдержке не менее 30 сек, характеризуется высокой биоактивностью и твердостью.
Литература
1. Paital S.R., Dahotre N.B. Calcium phosphate coatings
for bio-implant applications: Materials, performance factors, and methodologies
// Materials Science and Engineering R, 2009. – No. 66. – pp. 1–70.
2. Fomin A.A. et al.
Nanocrystalline Structure of the Surface Layer of Plasma-Sprayed Hydroxyapatite
Coatings Obtained upon
Preliminary Induction Heat Treatment of Metal Base // Technical Physics Letters, 2012, Vol. 38, No. 5, pp. 481-483.
3. Catledge S.A., Fries M.,
Vohra Y.K. Nanostructured surface modifications for biomedical implants //
Encyclopedia of nanoscience and nanotechnology, edited by H.S. Nalwa. – Vol. 10. – pp. 1-22.
4. Коршунов А.В., Ильин А.П., Лотков А.И., Раточка
И.В., Морозова Т.П., Лыкова О.Н. Особенности окисления субмикрокристаллического
титана при нагревании в воздухе // Известия Томского политехнического
университета. 2011. Т. 319. № 3. С.10-16.
5. Фомин А.А., Штейнгауэр А.Б., Родионов И.В., Анников В.В., Петрова Н.В., Захаревич А.М., Грибов А.Н. Нанометровые характеристики морфологически гетерогенных биосовместимых покрытий, получаемых на титане при воздействии токов высокой частоты // Гетеромагнитная микроэлектроника, 2012. – Вып. 13. – С. 57-63.