Водоснабжение и канализация/Экология
К.т.н.
Квартенко А.Н. Национальный университет
водного хозяйства и природопользования, г. Ровно, Украина
К.х.н.
Грюк И.Б. Тернопольский национальный
педагогический университет им. В. Гнатюка, г. Тернополь, Украина
Теоретические
основы механизмов химических реакций
в технологических
схемах обезжелезивания слабокислых, низкощелочных природных вод с использованием щелочных реагентов
Известно, что железо в природных водах
может находиться в виде двух и трехвалентных ионов, гидрокарбонатов,
комплексных соединений с гуминовыми и фульвокислотами, коллоидов как
органического, так и минерального происхождения [1-3]. В слабокислых водах с
низким щелочным резервом и присутствием растворенной органики железо находится
в виде стабильных железоорганических комплексов. Использование методов упрощенной либо глубокой
аэрации для разрушения и окисления,
последних не дает надлежащих результатов [1,3]. Традиционной для очистки таких
вод является технологическая схема
аэрация ® подщелачивание ® отстаивание ® фильтрование c последовательным использованием процессов окисления – гидролиза –
подщелачивания – коагуляции – отстаивания – фильтрования [1,2,4,5]. Рассмотрим развитие
механизмов химических реакций в технологических схемах реагентного
обезжелезивания природных вод при использовании некоторых щелочных регентов.
Схема реакции с использованием в качестве подщелачивающего реагента
раствора гашеной извести ![]() :
:
![]() (1)
(1)
Полное молекулярно-ионное уравнение
процесса:
![]() (2)
(2)
В результате реакции происходит
увеличение концентрации ионов гидроксильной группы ![]() , вводимых в водную систему извне, приводящее к
нарушению ее равновесия, повышению величины рН
и гидратной щелочности. Согласно
принципу Ле Шателье – Брауна измененное таким образом состояние равновесия
системы приводит к ускорению процессов перехода растворимой формы железа
, вводимых в водную систему извне, приводящее к
нарушению ее равновесия, повышению величины рН
и гидратной щелочности. Согласно
принципу Ле Шателье – Брауна измененное таким образом состояние равновесия
системы приводит к ускорению процессов перехода растворимой формы железа ![]() в осадок
в осадок ![]() .
.
Проанализировав вышесказанное, можно
сделать следующий вывод: для ускорения процесса окисления растворенной формы ![]() при обезжелезивании
слабокислых природных вод с низким щелочным резервом процесс аэрации следует
проводить в присутствии щелочного реагента.
при обезжелезивании
слабокислых природных вод с низким щелочным резервом процесс аэрации следует
проводить в присутствии щелочного реагента.
Схема реакции с использованием в качестве подщелачивающего реагента
раствора кальцинированной соды![]() :
:
![]() (7)
(7)
В водной среде кальцинированная сода![]() диссоциирует:
диссоциирует:
![]() (3)
(3)
с последующим гидролизом по аниону:
![]() (4)
(4)
Тогда полное молекулярно-ионное
уравнение процесса гидролиза кальцинированной соды имеет вид:
![]() (5)
(5)
Полное молекулярно-ионное уравнение
реагентного процесса обезжелезивания по данной схеме:
![]() (6) Сокращенное молекулярно-ионное
уравнение процесса:
(6) Сокращенное молекулярно-ионное
уравнение процесса:
![]() (7)
(7)
В результате реакции происходит
повышение гидрокарбонатной щелочности воды, необходимой для нормального
прохождения процесса окисления ионов ![]() в природных водах с
низким щелочным резервом и образуется однородный осадок
в природных водах с
низким щелочным резервом и образуется однородный осадок ![]() , что позволяет упростить технологическую схему очистки: аэрация
®
подщелачивание ® фильтрование.
, что позволяет упростить технологическую схему очистки: аэрация
®
подщелачивание ® фильтрование.
Рассмотрим теоретические аспекты
химического механизма процесса реагентного обезжелезивания природных вод по
схеме: подщелачивание ® аэрация ®отстаивание ® фильтрование. Согласно данной схеме на первом ее этапе одновременно происходят процессы
диссоциации и гидролиза гидрокарбоната железа (II) и гашеной извести:
![]() (8)
(8)
![]() (9)
(9)
![]() (10)
(10)
![]() (11)
(11)
![]() (12)
(12)
Присутствие в воде ионов гидроксильной
группы ![]() сдвигает равновесие
реакции гидролиза соли железа
сдвигает равновесие
реакции гидролиза соли железа ![]() в сторону образования
продуктов реакции (8). Известно, что
гидрокарбонат железа – кислая соль, образованная слабым основанием
в сторону образования
продуктов реакции (8). Известно, что
гидрокарбонат железа – кислая соль, образованная слабым основанием ![]() и слабой угольной кислотой
и слабой угольной кислотой ![]() - гидролизуется
полностью и по катиону, и по аниону. В присутствие ионов гидроксильной группы
- гидролизуется
полностью и по катиону, и по аниону. В присутствие ионов гидроксильной группы ![]() , введенных с раствором извести
, введенных с раствором извести ![]() , гидролиз ускоряется и идет до конца. Реакция
сопровождается выделением углекислоты, которая, связываясь в щелочной среде с
катионами
, гидролиз ускоряется и идет до конца. Реакция
сопровождается выделением углекислоты, которая, связываясь в щелочной среде с
катионами ![]() , образует осадок:
, образует осадок:
![]() (13)
(13)
Суммарное уравнение реакции гидролиза:
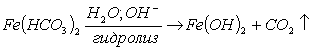 (14)
(14)
Полное молекулярное уравнение
обезжелезивания воды согласно рассматриваемой схеме:
![]() (15)
(15)
С последующей стадией окисления:
![]() (16)
(16)
Однако, как следует из полного
молекулярного уравнения реакции (15), в результате параллельного гидролиза как
исходных, так и вводимых в систему извне компонентов, происходит выпадение осадка карбоната кальция, что в
свою очередь приводит к усложнению технологических процессов из-за
необходимости введения перед процессом окисления блока раздела фаз.
Использование кальцинированной соды в
качестве подщелачивающего реагента по данной схеме реагентного обезжелезивания
природных слабокислых вод [6] позволяет отказаться от блока разделения фаз и
рассматривать протекание комплекса химических реакций по следующему механизму:
диссоциация соединений ![]() с последующим их
гидролизом, вывод продуктов гидролиза из зоны реакции с последующим окислением
соединений
с последующим их
гидролизом, вывод продуктов гидролиза из зоны реакции с последующим окислением
соединений ![]() кислородом воздуха:
кислородом воздуха:
1этап: диссоциация соединений ![]() :
:
![]() (17)
(17)
2 этап: гидролиз ![]() по аниону:
по аниону:
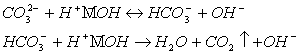 (18)
(18)
3 этап: диссоциация кислой соли ![]() :
:
![]() (19)
(19)
4 этап: гидролиз
гидрокарбоната железа (II) по катиону:
![]()
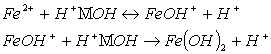 (20)
(20)
гидролиз гидрокарбоната железа (II) по аниону:
![]() (21)
(21)
Полное молекулярно-ионное уравнение реакции:
![]() (22)
(22)
Сокращенное молекулярно-ионное уравнение реакции:
![]() (23)
(23)
Поскольку в результате гидролиза в воде
одновременно присутствуют ионы ![]() и
и![]() , параллельно происходит процесс образования мало
диссоцированного вещества – воды:
, параллельно происходит процесс образования мало
диссоцированного вещества – воды: ![]() , что выводит продукты гидролиза из зоны реакции и
способствует более полному протеканию процесса образования
, что выводит продукты гидролиза из зоны реакции и
способствует более полному протеканию процесса образования ![]() с его последующим
окислением кислородом воздуха:
с его последующим
окислением кислородом воздуха:
![]() (24)
(24)
Таким образом обеспечивается непрерывность
прохождения химических реакций гидролиза с последующим окислением продуктов
реакции и как следствие достигается интенсификация процесса реагентного
обезжелезивания природных вод без кардинальных капитальных затрат в существующих технологических процессах.
Литература:
1.
Николадзе Г.И. Обезжелезивание природных и оборотных вод /
Г.И. Николадзе - М.: Стройиздат, 1978.
– 160 с.
2.
Золотова Е.Ф., Асс Г.Ю. Очистка воды от железа, марганца,
фтора и сероводорода / Е.Ф. Золотова –
М.: Стройиздат, 1975. - 176 с.
3.
Николадзе Г.И. Улучшение качества подземных вод /
Г.И. Николадзе – М.: Стройиздат, 1987.
– 240 с.
4.
Милов М.А. Исследование процесса очистки вод с высоким
содержанием железа методом фильтрования: автореф. дисс. … канд. техн. наук /
М.А. Милов.– Новосибирск: НИСИ, 1975. – 31 с.
5.
Журба М.Г., Говорова Ж.М. Водоснабжение. Улучшение качества
воды: Учебник для вузов: В 3-х тт. / М.Г. Журба - Том 2.– М.: Изд-во АСВ, 2008.
– 544 с.
6.
Квартенко А.Н. Характеристика подземных вод
Северо-Западных областей Украины и технологические схемы их кондиционирования
// Проблеми водопостачання, водовідведення та гідравліки: Науково-технічний
збірник / А.Н. Квартенко - Вип. 16. – К.: КНУБА, 2011. - С. 32-41.