Биологические науки/6. Микробиология
Пучкова Л.
И., Афонина В.С., Андреева И.С., Селиванова М.А., Мазуркова Н. А., Макаревич Е. В.
Федеральное
бюджетное учреждение науки ГНЦ ВБ «Вектор», ФБУН ГНЦ ВБ «Вектор», п. Кольцово
Новосибирской области, Россия.
Штамм бактерий Serratia species Bp-471 – обладающий
противовирусыми свойствами в отношении вирусов гриппа типа А
При разработке средств профилактики и терапии вирусных
инфекций большое внимание уделяется
изучению нуклеаз — ферментов, деполимеризующих нуклеиновые кислоты. К
списку нуклеаз, проявляющих противовирусные свойства на моделях in vitro, относят панкреатические РНКазы, ДНКазы, Установлено, что рибонуклеазы обладают выраженной
противовирусной активностью в отношении таких РНК-содержащих вирусов, как
вирусы гриппа, полиомиелита, клещевого
энцефалита. Дезоксирибонуклеазы тормозят синтез и размножение ДНК-содержащих
вирусов, осповакцины, аденовируса, герпеса [1]. Одним из наиболее изученных энзимов этого класса является
секретируемая эндонуклеаза из штамма Serratia marcescens (Sma nuc). Штаммы рода Serratia широко известны как продуценты
различного рода препаратов. В качестве продуцента
нуклеазы, обладающей РНКазной и ДНКазной активностями наиболее изучен штамм Serratia marcescens В-10 М-1 [2-4]. Обнаружение нуклеаз с новыми
свойствами позволит создать препараты, обладающие разными видами биологической
активности.
Цель нашей работы - получение нового
штамма бактерий Serratia species Bp-471 - продуцента внеклеточной рибонуклеазы и
дезоксирибонуклеазы для дальнейшего использования в биотехнологии. Штамм выделен в результате изучения образцов воды озера Байкал. Для
выделения бактерий-продуцентов
нуклеолитических ферментов была
применена методика отбора колоний на селективных средах [5] и метод гидролиза
фаговых ДНК (Т7 или λ) [6]. Для
определения таксономической принадлежности бактерий Serratia sp. Bp-471 стандартными методами исследовали фенотипические
признаки и определяли нуклеотидные последовательности продуктов ПЦР,
соответствующие гену 16S рРНК, в Межинститутском Центре секвенирования ДНК СО
РАН (г. Новосибирск). Определение до
вида проводили по определителю Бердже [9].
При культивировании применяли питательную среду “S” (Пептон, NaCI, МgCl2х6 Н2О,
Трис-буфер, pH 8.0) или “LB” (дрожжевой экстракт,
пептон, NaCI, pH 7,2) “Difco”.
Для исследования использовали клеточные экстракты (КЭ)
штамма и культуральную жидкость (КЖ) после культивирования.
Для получения клеточных экстрактов бактериальные
клетки лизировали лизоцимом (05,мг/мл) с добавлением тритона
Х-100 (0,1%) в ТN-буфере (0,01М Трис рН 7,5; 0,5М NaCI, Н2О деионизованная) или разрушали
ультразвуком в 4-х мл Н2О на дезинтеграторе “MSE” (Великобритания).
Количественное определение РНКазной и ДНКазной активности проводили по превращению субстратных
нуклеиновых кислот: суммарной дрожжевой РНК (НИКТИ БАВ ГНЦ ВБ «Вектор») и ДНК
из молок лосося (Медиген, Новосибирск) во фрагменты, которые растворимы в
4%-ной HClO4, с
появлением кислоторастворимого материала с адсорбцией при 260 нм.
При лабораторной проверке активности оказалось, что
штамм Serratia sp. Bp-471 обладает РНКазной и ДНКазной активностями.
Средняя рибонуклеазная активность штамма составила
252,5 ед.акт/мл КЖ, а активность клеточного экстракта 261,8 ед.акт/мл или
2094,4ед.акт/г влажной биомассы. Максимальная активность КЭ была получена на
среде “S” и составила 6692,4 ед.акт/г биомассы.
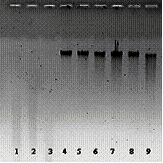
На рисунке приведены данные по исследованию КЖ штамма Serratia sp. Bp-471 на ДНКазную активность в агарозном геле. На
рисунке видно, что ферменты КЖ штамма Serratia sp.Bp-471(Вр-471) полностью гидролизуют ДНК фага λ уже
за 5 мин инкубации (дорожки 1-3). В то время как КЖ двух других штаммов не
гидролизуют λ ДНК в этих же условиях даже за 30 мин, и ДНК хорошо видно на
гелевой пластине.
|
|
Рис. Анализ КЖ бактериальных штаммов на содержание внеклеточных
ферментов (1-3) –штамм Вр-471, (4-6) –штамм Вр-1010, (7-9) –штамм Вр-577 Время инкубации с
ДНК фага λ: (1,4,7)
- 5 мин, (2,5,8) - 10 мин, (3,6,9) - 30 мин. |
Штамм бактерий Serratia sp. Bp-471 обладает ДНКазной активностью и гидролизует не только
ДНК фага λ (рис.), но и ДНК фага Т7 и ДНК из молок лосося.
Определение противовирусной активности
препаратов. Для оценки
противовирусной эффективности полученных препаратов использовали
высокопатогенный вирус гриппа птиц A/chicken/Kurgan/05/2005(A/H5N1) с титром
103,5-6,5 lg ТЦД50/мл
и вирус гриппа человека A/Aichi/2/68 с
титром 102,5-3,5 lg ТЦД50/мл
вирусаллантоисной жидкости (ВАЖ)) из отдела «Коллекция микроорганизмов» ФБУН
ГНЦ ВБ «Вектор» и наработанные в отделе профилактики и лечения ООИ ФБУН ГНЦ ВБ
«Вектор». Для тестирования токсичности и противовирусной активности препаратов
использовали перевиваемую культуру клеток MDCK.
Для определения токсических доз препараты разводили в 2, 5 и 10
раз средой Axcevir-MDCK. С помощью инвертированного микроскопа оценивали
наличие токсического действия в монослоях клеток MDCK, инкубированных с разными
концентрациями препаратов.
Для определения противовирусной активности
препаратов готовили десятикратные разведения ВАЖ от 1 до 8 с использованием
среды Axcevir-MDCK, содержащей 2 мкг/мл трипсина. В монослой культуры клеток
MDCK вносили по 50 мкл выбранного разведения препарата и 100 мкл от 1 до 8
разведения ВАЖ. Клетки инкубировали 2 суток при температуре 37°С в атмосфере 5%
СO2 в термостате ТС-1/80 СПУ (Россия). Через 2 суток с помощью инвертированного
микроскопа регистрировали ЦПД в монослое клеток и определяли наличие вируса в
среде культивирования по реакции гемагглютинации (РГА) с 1% эритроцитами
петуха.
Препараты
готовили c использованием штамма Serratia sp. Bp-471, наработанного в жидкой среде при температуре
28-30°С. в течение 24 часов на термостатированной качалке (КТ 104, Россия). Для
приготовления препарата на основе культуральной жидкости полученную КЖ штамма
центрифугировали при 10000 об/мин в течение 30 мин на центрифуге JA-21. После
УЗ-обработки разрушенные клетки осаждали центрифугированием при 10000 об/мин на
микроцентрифуге “Eppendorf”, Культуральную жидкость
и КЭ стерилизовали ультрафильтрацией через Whatman фильтр с размерами пор 0,2
мкм и использовали для испытания в качестве противовирусного препарата. Хранили
препарат при температуре минус 20°С.
Клеточный экстракт (КЭ) штамма Serratia sp. Bp-471, полученный на среде LB (препарат №11-11) проверили в профилактической схеме
на противовирусную активность. Препарат нейтрализовал вирус гриппа человека A/Aichi/2/68 на
100%. Титр вируса в контроле (КВ) составил 102,5 lg ТЦД50/мл.
Для испытания в профилактической схеме на вирусе
гриппа птиц, препарат №11-19 (табл.) развели в 5 раз. Планшеты с обработанными
клетками и вирусом помещали в термостат при температуре 37°С, 5% СO2
и 100% влажности на 2-3 суток до образования монослоя. Индекс нейтрализации
составил 3,5 lg (табл.). Осадок клеток штамма Serratia sp. Bp-471, выращенных на среде “S”. освобождали от надосадочной
жидкости и ресуспендировали в 4 мл дистиллированной Н2O Процент
разрушения на ультразвуковом (УЗ)-дезинтеграторе составил 75%. Полученный КЭ разводили
в 2 раза и использовали для испытания на противовирусное действие на вирусе
гриппа птиц H5N1 (образец 12-57).
Препарат нейтрализовал вирус на 100%. КВ составил 106,5 lg ТЦД50/мл.
Таблица. Противовирусное действие КЭ и КЖ
штамма Serratia sp. Bp-471
|
№ 0бразца |
Вид образца |
РНКазная активность, Е/мг белка |
Индекс нейтрали-зации
вируса |
|
А/Aichi/2/68(H3N2) |
|||
|
11-11 |
КЭ |
68,9 |
2,5 lg |
|
11-19 |
КЖ |
50,8 |
3,5 lg |
|
A/chikenKurgan/05/2005(H5N1) |
|||
|
11-19 |
кж |
50,8 |
3,5 lg |
|
12-57 |
КЭ |
64,8 |
6,5 lg |
Таким образом, показано, что штамм бактерий Serratia sp. Bp-471 обладает противовирусной активностью в
профилактической схеме анализа на культуре клеток MDCK в отношении вирусов
птичьего гриппа H5N1 и вируса
гриппа человека H3N2 и может быть
использован для разработки препарата с противовирусными свойствами. Штамм Serratia species Bp-471 депонирован в «Коллекции бактерий, бактериофагов и
грибов ФБУН ГНЦ ВБ «Вектор» под коллекционным номером В-1287.
Литература:
1.
Чижов Н.П.
Противовирусное действие нуклеаз и гистонов. //Вопросы вирусологии. ─
1974. ─№6. ─ С. 647-652.
2. Нуклеазы микроорганизмов и их практическое
использование. Рига, 1989, с.3.
3.
Биосинтез
микроорганизмами нуклеаз и протеаз. М.: Наука, 1979, с.7.
4.
Детиненко Л.Д., Клименко В.П., Подгорный В.Ф., Аликин Ю.С. Патент РФ. № 2038776, 1995г.
5.
Методы общей
бактериологии /под ред. Ф. Герхарда и др. – М.: Мир, 1983. –
Т. 1. – 536 с.; 1984. Т. 3. 264 с.
6.
Пучкова Л.И., Калмыкова Г.В., Бурцева Л.И., Репин В.Е. // Прикл. биохимия
и микробиология. 2002. Т. 38. № 2. С. 140–144.
- "Bergey's Manual of Systematic
Bacteriology". 8th ed. / Ed. John G. Holt. – Baltimore-London, Williams and Wilkins, 1986. – V.1-2.–1105 p.