Панасенко А.И., Парченко
В.В., Кремзер А.А., Мельник И.В., Постол Н.А., Самура Т.А., Кулиш С.Н.
Запорожский
государственный медицинский университет
Противогрибковая и противомикробная активность производных
4-метокси-7-нитро-9-гидразоно акридинов
Бактериальная
резистентность по отношению к многим доступным антибактериальным средствам
является растущей проблемой. Соответственно, разработка новых антибактериальных
агентов, которые могут решить проблему резистентности стала предметом ряда
исследований [1, 3].
В
данной работе, мы использовали производные 4-метокси-7-нитро-9-гидразоно
акридинов, так как к этим азагетероциклам вырабатывается низкая
антибиотикорезистентность микроорганизмов.
Для изучения антибактериальной активности
4-метокси-7-нитро-9-гидразоно акридинов использовали метод серийных разведений
в бульоне. В качестве питательной среды применяли аминопептид, предварительно
разведенный водой, рН среды 7,2. Микробная нагрузка для бактерий составляла
2,5·105 клеток аминопептидной 18-часовой культуры в 1 мл среды,
максимальная из испытуемых концентраций веществ составляла
250 мкг/мл [2].
Для выращивания грибков использовали бульон
Сабуро (рН 6,5-6,8). Нагрузка их составляла 500 000 репродуктивных телец в
1 мл. Изучали на 8-ми штаммах микроорганизмов:
|
1. Staphylococus
aureus 2. E.
coli 3. S. typhi №4446 4. S. dysentheriae
Flexneri 1675 e 5. Proteus vulgaris 6. Pseudomonas
aeruginosa 165 7. B. Antracoides 8. Candida albicans |
-
стафилококк золотистый №209-4 -
кишечная палочка -
брюшнотифозная палочка -
дизентерийная палочка Флекснера 1675 Е -
протей -
синегнойная палочка 165 -
палочка антракоида |
Таблица 1
Противомикробная и
противогрибковая активность исследуемых веществ*
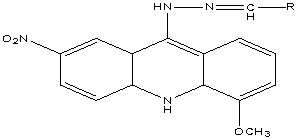
|
Соед. |
R |
Минимальная бактериостатическая и фунгистатическая
концентрация, мкг/мл |
|||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
||
|
1 |
фенил |
250 |
+ |
125 |
+ |
31,2 |
125 |
+ |
125 |
|
2 |
2,4-диметиламинофенил |
+ |
250 |
+ |
250 |
+ |
+ |
250 |
250 |
|
3 |
2,4-диэтиламинофенил |
250 |
+ |
125 |
+ |
62,5 |
250 |
+ |
31,2 |
|
4 |
2-нитрофенил |
+ |
250 |
+ |
250 |
+ |
250 |
+ |
125 |
|
5 |
3-нитрофенил |
125 |
250 |
250 |
250 |
250 |
250 |
62,5 |
125 |
|
6 |
4-нитрофенил |
250 |
125 |
+ |
250 |
+ |
+ |
+ |
62,5 |
|
7 |
2-оксифенил |
250 |
+ |
250 |
+ |
250 |
250 |
+ |
125 |
|
8 |
2-метоксифенил |
+ |
+ |
+ |
+ |
125 |
+ |
125 |
250 |
|
9 |
4-метоксифенил |
125 |
+ |
125 |
250 |
+ |
250 |
+ |
31,2 |
|
10 |
2,4-диоксифенил |
+ |
+ |
+ |
+ |
250 |
125 |
250 |
125 |
|
11 |
этакридина
лактат |
7,8 |
62,5 |
31,2 |
31,2 |
125 |
125 |
125 |
125 |
При анализе данных
исследований, как и в серии предыдущих опытов, отмечается высокая
противогрибковая активность соединений, что подтверждает актуальность поиска
противогрибковых и противомикробных средств в ряду производных акридина.
Так, из таблицы 1 видно, что
только два соединения уступают по своей активности эталонному препарату
этакридина лактату. Касательно всех остальных соединений, то можно утверждать,
что при низких концентрациях соединений (31,2-125 мкг/мл) угнетают рост дрожжеподобного грибка.
По бактериостатическому действию исследуемых
соединений следует отметить их действие по отношению к золотистому стафилококку
№209-4 и в отношении протея. Так, в отношении протея оказались активнее чем
референс препарат этакридина лактат соединения 1 и 3, которые в концентрации
31,2 мкг/мл и 62,5 мкг/мл угнетали рост протея.
Выводы
1. Все исследуемые соединения перспективны в плане их дальнейшего
исследования в плане противогрибковой активности.
2. Высокоактивным веществом по отношению ряда исследуемых микроорганизмов
можно считать соединение 5, которое хоть и подавляет рост при максимальной
исследуемой концентрации, но проявляет свою активность по отношению всех
исследуемых микроорганизмов.
Литература
1. Клиническая микробиология и антимикробная химиотерапия, 2013; Том 15, № 2, Приложение 1. – С.
10-50.
2.
Клиническая микробиология и антимикробная химиотерапия. - Журнал,
2004г. Т. 6 № 4 C. 306-359.
3. Synthesis and Antibacterial Activity of Novel
Curcumin Derivatives Containing Heterocyclic Moiety / Othman A.
Hamed, Noha Mehdawi, Adham Abu
Taha, Emad M. Hamed, Mohammed A.
Al-Nuri, and Ayman S.
Husseinc// Iran J Pharm Res. 2013 Winter;
12(1): 47–56.