Биологические науки/8.Физиология человека
и животных
Д.б.н. КОЛБАЙ И.С.,
к.б.н. БЕГИМБЕТОВА Д., к.б.н. ДЖАКИБАЕВА Г.Т.
РГП»Центральная
лаборатория биоконтроля, сертификации и предклинических испытаний» Казахстан,
г.Алматы
Оценка мутагенных
свойств препарата метилиодида диметиламиногроссгемина
В настоящее время растения являются источниками
около 10.000 соединений различных классов, используемых в качестве сердечных
препаратов, противоопухолевых средств, гормонов, диуретиков, антибиотиков,
анальгетиков и т.д. При этом следует отметить, что биологически активные
вещества растений пока остаются единственным источником для получения ряда
незаменимых противоопухолевых, антиаритмических, кардиотонических, адаптогенных
и других препаратов.
Гроссгемин
относится к сесквитерпеновым соединениям и содержится в листьях артишока. Сырье
артишока (листья) содержит также фенольные соединения (цинарин),
сесквитерпеновые соединения (гроссгемин, цинаропикрин), флавоноиды, витамины С,
В1, В2, каротиноиды и др.
Артишок снижает уровень холестерина в
сыворотке крови, стимулирует желчеобразование и желчевыведение, обладает
противовоспалительной, антиоксидантной и гепатопротекторной активностью,
усиливает антитоксическую функцию печени, нормализует процессы пищеварения,
способствует почечной фильтрации, регулирует функцию щитовидной железы.
Артишок рекомендуется принимать при
холецистите, токсическом поражении и жировой дегенерации печени, сахарном
диабете, атеросклерозе, ревматизме, сердечной и почечной недостаточности, при
аллергических заболеваниях, экземе, псориазе, отравлении опиумом.
В современной фитотерапии применяются
преимущественно растения с низкой токсичностью и хорошей переносимостью. Однако
и среди них попадаются такие, которые при неправильном обращении или слишком
длительном применении могут вызвать существенные побочные эффекты.
Изготовители фитофармацевтических
средств стремятся производить препараты, в которых сохранилось бы как можно
больше ингредиентов, изначально находившихся в растении, причем в их
«естественном, сбалансированном соотношении. Многие фитофармацевтические
средства стандартизуются, качественно и количественно оцениваются по содержанию
в них, так называемых основных субстанций или тех субстанций, которые считаются
эффективными. Это могут быть и субстанции, преобладающие в данном лекарственном
средстве. Такие препараты, как правило, делают на основе дорогостоящей и
сложной экстракции, цель которой – добиться более высокого содержания
биоактивных веществ в препарате. [1-4].
Способы производства
фитопрепаратов
разнообразны. При
этом
используют
либо
все
растение (лат.planta herba), цветки (floes), листья (folium), корни (radices), плоды (fructus), семена (semina), кору (cortices), корневища (rhizomata). Изготавливают
сок из свежего сырья, спиртовые, масляные, спиртово-водные и водные извлечения.
Сухие или специально высушенные части превращают в порошок, иногда
спрессовывают в таблетки, либо измельчают для дальнейшего приготовления сборов.
Экстракты или вытяжки в большинстве случаев содержат различные ингредиенты в
различной концентрации в зависимости от того, какой растворитель применялся.
К сожалению, растительные препараты
очень часто бывают различного качества. Это зависит от исходного состояния
растительного сырья, тщательности подготовки и обработки полуфабрикатов, а
также соблюдения параметров концентрации. Только высокое качество
фитопрепаратов может обеспечить им необходимые свойства и действие в
стандартной терапии.
Значительную часть пациентов, которым рекомендованы фитотерапевтические
препараты, составляют больные с легкими симптомами заболеваний и с такими
симптомами, которые можно трактовать двояко или приписывать проявлением
различных нарушений, однозначные научно-обоснованный диагноз которых поставить
трудно. Кроме того, большую долю составляют пациенты с хроническими
заболеваниями и симптомами, которые нельзя оставлять без медикаментозного
контроля, пациенты, при лечении которых эффект достигается не в последнюю
очередь за счет психодинамической реакции. Фитотерапия актуальна для пациентов
с хроническими заболеваниями, когда фитопрепараты играют роль сопроводительной
терапии; для пожилых пациентов, когда фитопрепараты применяются в течение очень
долгого времени и требуется мягкий терапевтический эффект и безопасность.
2 Материал и методы исследования
В экспериментах по изучению мутагенного действия фитопрепарата метилиодида
диметиламиногроссгемина были использованы 12 белых беспородных крыс-самцов
половозрелого возраста. Масса лабораторных животных в среднем составляла
250-270 грамм.
Интактные и опытные животные были разделены на 3
группы по 4 крысы в каждой: I - интактные животные; II -
животные, получавшие однократно (острое воздействие) перорально фитопрепарат
метилиодида диметиламиногроссгемин в дозе 5 мг/100 г массы тела; III
- животные, получавшие в течение 10-ти суток (многократное воздействие)
перорально фитопрепарат метилиодида диметиламиногроссгемин в дозе 5 мг/100 г.
Интактные и опытные животные содержались в
условиях вивария на стандартном рационе [5].
Крыс забивали под эфирным наркозом, забирали
костный мозг – для цитогенетического анализа.
Цитогенетический
метод анализа хромосом
Для установления мутагенной активности
фитопрепарата использовали тест по учету хромосомных и геномных мутаций в клетках костного мозга.
Перед забоем определяли массу каждой крысы.
Внутрибрюшинно животным вводили 0,04% раствор колхицина из расчета 1 мл на 100
г массы тела. Через 1,5-2 часа после инъекции колхицина крыс забивали и
готовили цитологические препараты по общепринятой методике. После забоя у
животных извлекали бедренную кость, отрезали эпифизы и клетки костного мозга
вымывали в центрифужную пробирку гипотоническим раствором 0,56 % КCl (t=37Со)
объемом 5 мл. Клетки костного мозга ресуспендировали в растворе с помощью
пастеровской пипетки. Взвесь клеток оставляли в термостате на 10 минут. Затем
клетки центрифугировали в течение 5 минут (1000 об.), удаляли надосадочную
жидкость и осторожно по стенке добавляли холодную смесь фиксатора, состоящего
из 3-х частей этанола и 1 части ледяной уксусной кислоты. Клетки фиксировали
трехкратно по 20 минут. Общее время фиксации было не меньше 1 часа. После
окончания фиксации клетки раскапывали с помощью пастеровской пипетки на мокрые
холодные обезжиренные стекла под углом 45о, которые затем высушивали
в термостате при t=37Со. Для окраски хромосом
использовали краситель азур-эозин по Романовскому-Гимзе. Метафазные пластинки
анализировали и фотографировали в световом микроскопе Axioskop-40 (Zeiss).
Полученные результаты
статистически обрабатывали [6] с привлечением непарного критерия
Фишера-Стьюдента и изменения считали достоверными при р≤0,05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ
В результате
цитогенетического анализа был идентифицирован диплоидный набор хромосом Rattus norvegicus: 2n=42 (рисунок 1).
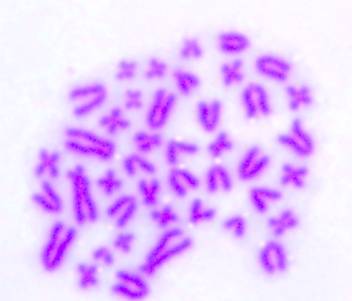
Рисунок 1 – Диплоидный набор хромосом Rattus norvegicus в норме.
Gimsa, ×1000.
Результаты цитогенетического анализа клеток
костного мозга крыс, подвергнутых острому воздействию фитопрепарата метилиодида
диметиламиногроссгемин, приведены в таблице 3.
Таблица
1 Цитогенетический анализ клеток костного мозга крыс, подвергнутых острому
воздействию фитопрепарата метилиодида диметиламиногроссгемин
Как видно из представленной таблицы общая
частота аберрантных клеток и аберраций на 100 метафаз у животных контрольной
группы составил 0,91 %. Хромосомные нарушения были представлены аберрациями как
хромосомного, таки и хроматидного типа, с преобладанием последнего.
При остром воздействии фитопрепарата на крыс при
цитогенетическим анализе общий уровень аберрантных клеток и аберраций на 100
метафаз составил 1,23 %. Как и в контрольной группе, уровень хромосомных
нарушений преобладал за счет аберраций хроматидного типа.
При подостром воздействии фитопрепарата на крыс
частота аберрантных клеток и аберраций на 100 метафаз у животных составил 1,12
%, и, как и у животных предыдущих групп наблюдалось преобладание хромосомных
нарушений хроматидного типа.
Сравнительный анализ цитогенетического
исследования между контрольными животными и животными группы острого
воздействия фитопрепарата показал, что
общая частота структурных нарушений, частота хромосомных и хроматидных
нарушений у опытной группы была в 1,4; 1,8 и 1,3 раза, соответственно, выше по
сравнению с контрольной группой. Однако это превышение было статистически
недостоверным.
При сравнительном анализе контрольной группы и
группы животных подострого воздействия фитопрепарата также наблюдалось
превышение общего уровня аберрантных клеток и частоты хроматидных нарушений у
опытной группы по сравнению с контролем. Данное превышение также оказалось
статистически недостоверным. Частота хромосомных нарушений у обеих групп
оставалась на одном уровне.
Общая частота и уровень хроматидных нарушений у
животных обеих опытных групп (острое и подострое воздействие фитопрепарата)
была практически на одном уровне. Превышение частоты хроматидных нарушений у
животных острого воздействия фитопрепарата по сравнению с животными подострого
воздействия было статистически недостоверным.
Спектр хромосомных нарушений во всех
изучаемых группах был представлен хроматидными делециями (рис. 2), хроматидными
фрагментами (рис. 3) и парными делециями фрагментами (рис.4).
![]()
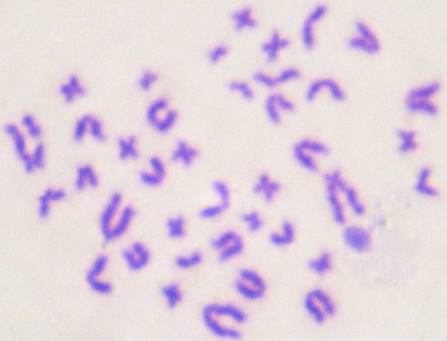
Рисунок 2 – Хроматидная делеция.Gimsa, ×1000.
![]()
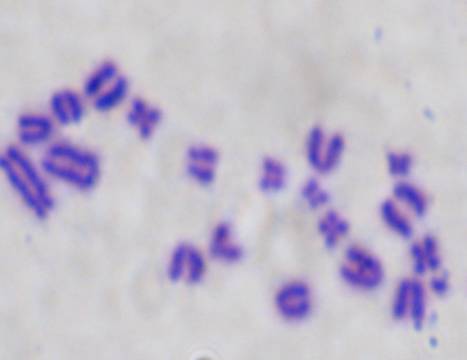
Рисунок 3 – Хроматидный фрагмент.Gimsa, ×1000.
![]()
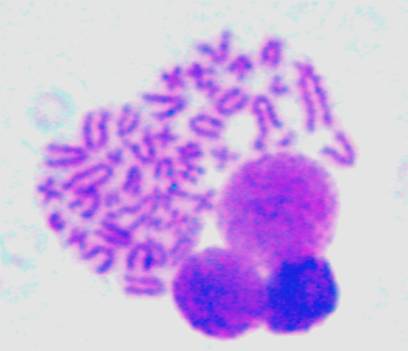
Рисунок 4 – Парные делеции.Gimsa, ×1000.
При цитогенетическом анализе полиплоидные
клетки не были обнаружены.
Таким образом, результаты цитогенетического
анализа острого и подострого
воздействия метилиодида диметиламиногроссгемин на крыс не выявили выраженного
мутагенного эффекта изучаемого фитопрепарата.
СПИСОК ИСПОЛЬЗОВАННЫХ ИСТОЧНИКОВ
1 Бердимуратова Г.Д., Музычкина Р.А., Корулькин
Д.Ю., Абилов Ж.А., Тулегенова А.У. Биологически активные вещества растений.
Выделение, разделение, анализ. – Алматы: Атамұра,2006. -483 с.
2Корулькин Д.Ю., Абилов Ж.А., Музычкина Р.А.,
Толстиков Г.А. Природные флавоноиды. –Новосибирск: Изд-во СО РАН, 2007. -296 с.
3Музычкина Р.А.. Корулькин Д.Ю., Абилов Ж.А.
Качественный и количественный анализ основных групп БАВ в лекарственном растительном
сырье и фитопрепаратах. –Алматы: Қазақ университетi,2004.
-283 с.
4Muzychkina R.A.
Natural anthraquinones. Biological properties and physico-chemical
characteristics. –Moscow:Publishing House of Russian Academy of Sciences, 1998.
-864 p.
5Графодатский, А.С.,
Раджабли, С.И. Хромосомы сельскохозяйственных и лабораторных млекопитающих. -
Новосибирск: Наука, 1988. - 127 с.
6Рокицкий, Н.А. Введение в статистическую генетику. – Минск: Вышейшая школа,
1978. - 448 с.