Биологические науки /9. Биохимия и
биофизика
Д.т.н. Черно Н.К., к.х.н. Озолина С.А., Капустян А.И.
Одесская национальная академия пищевых
технологий, Украина
Иммобилизация трипсина путем включения
в
полиэлектролитные микрокапсулы
Одним из интенсивно развивающихся
направлений современной биотехнологии является иммобилизация высокомолекулярных
биологически активных веществ (БАВ) в нано- и
микрообъекты, такие как липосомы, мицеллы, микро- и
наночастицы [1-2].
Традиционные методы включения
высокомолекулярных БАВ в микро-объекты фиксированного размера и формы (сферы,
капсулы) основываются на физико-химических процессах преципитации, полимеризации, коацервации и др., которые предполагают использование
органических растворителей, поверхностно-активных
соединений, а также поперечно-сшивающих агентов. Это может сопровождаться снижением
биологической активности иммобилизованной составляющей. Актуальной является
разработка методов иммобилизации высокомолекулярных БАВ в микрообъекты в мягких
условиях.
В 1998 году учеными Института
коллоидной химии и химии поверхностей (Германия) был предложен новый тип
полифункциональных микрокапсул, состоящих из ядра и оболочки, способ получения
которых позволяет конструировать как внутренний объем, так и состав стенок, суть
которого заключается в послойной (Layer-by-Layer) электростатической самосборке (Electrostatic Self-Assembly) противоположно
заряженных полиэлектролитов на коллоидных частицах микронных и субмикронных
размеров [3-5].
Для формирования микрокапсул используют
в основном синтетические полиэлектролиты. Представляет интерес применение в
качестве компонентов микрокапсул природных разноименно заряженных полимеров,
обеспечивающих биосовместимость с активной составляющей а также биодеградируемость.
Целью исследования явилась оценка эффективности иммобилизации трипсина в
микрокапсулы, сформированные методом послойной адсорбции биополимеров-полиэлектролитов
на карбонатной матрице.
Карбонатные
частицы получали путем совмещения эквимолярных растворов хлорида кальция и
карбоната натрия. Включение трипсина в СаСО3 микрочастицы проводили
двумя методами: сорбцией и соосаждением [6]. В первом случае включение БАВ осуществляется
в результате его физической сорбции на поверхности предварительно сформированной
неорганической матрицы. В методе соосаждения формирование карбонатных микрочастиц
происходит при взаимодействии хлорида кальция и карбоната натрия с одновременным
включением в них фермента. Степень включения трипсина в состав нерастворимых
карбонатных микрочастиц контролировали по изменению его концентрации в жидкой
фазе.
Эффективность
включения трипсина в первом случае составила 48 %, во втором – 81 % от его содержания
в реакционной смеси, в связи с чем в дальнейшем иммобилизацию трипсина
проводили методом соосаждения.
Карбонатные ядра с иммобилизованным
ферментом поочередно инкубировали в растворах хитозана и пектина. Учитывая, что
частицы карбоната натрия несут отрицательный заряд (ζ=-13 mV),
первый наносимый слой формировали из хитозана (поликатион), следующий – из
пектина (полианаион) и далее в такой же очередности.
Данную процедуру повторяли до
образования необходимого количества слоев на поверхности неорганической
матрицы. Далее карбонатную матрицу растворяли добавляя к полученным микрочастицам
хелатирующий агент
(ЭДТА) – получили полые микрокапсулы.
Проницаемость
полиэлектролитной мембраны микрокапсул регулировали варьируя концентрацию
полисахаридов в интервале 0,1…1 %, молекулярную массу
хитозана (32 и 240 кДа), а также изменяя число слоев хитозана и пектина от 2 до
8.
Результаты
исследований показали, что наибольшая глубина расщепления субстрата
иммобилизованным трипсином имела место при формировании
полиэлектролитной оболочки микрокапсул с использованием 0,3 % растворов
полисахаридов. Увеличение их концентрации до 1,0 % приводило к образованию
поверхностных структур практически полностью препятсвующих проявлению ферментом
протеолитической активности. Такая зависимость была характерна для микрокапсул
с двух- и четырехслойной полисахаридными оболочками. В связи с этим в
дальнейших исследованиях оболочку капсул формировали используя 0,3 % растворы
полисахаридов.
На рис. 1
представлены данные, характеризующие глубину гидролиза казеина иммобилизованным
трипсином в зависимости от количества слоев полиэлектролитной мембраны (время инкубации 180 мин), которые свидетельствуют о том, что с увеличением
числа слоев полиэлектролитной оболочки микрокапсул глубина гидролиза субстрата
иммобилизованным ферментом умень-шается.
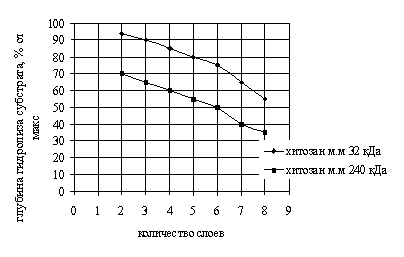
Рис. 1. Глубина гидролиза субстрата иммобилизованным
трипсином в ПЭМК в зависимости от количества слоев полиэлектролитов
Так, глубина
гидролиза казеина трипсином, включенным в восьмислойную мембрану, составляет
35…55 %; двухслойную – 70…95 %. При этом трипсин, иммобилизованный в полиэлектролитные
микрокапсулы, сформированные с участием высокомолекулярного хитозана, расщепляет
субстрат значительно медленнее, чем включенный в микрокапсулы, содержащие в
качестве полиэлектролитной составляющей низкомолекулярный хитозан.
Для
прогнозирования поведения иммобилизованного в полиэлектролитные микрокапсулы
(ПЭМК) трипсина в пищеварительном тракте человека, исследовали влияние на его
активность растворов, моделирующих жидкие среды желудочно-кишечного тракта. Гидролиз казеина свободным и иммобилизованным трипсином проводили при рН = 7
(кишечный сок) после предварительной инкубации фермента в среде, имитирующей
желудочный сок.
Установлено что
действие агрессивных сред желудочного сока (рН 1,35, пепсин) приводит к потере
95 % активности свободного трипсина и оказывает выраженное денатурирующее
действие на фермент, иммобилизованный в составе ПЭМК с двухслойной полиэлектролитной
мембраной (рис. 2).
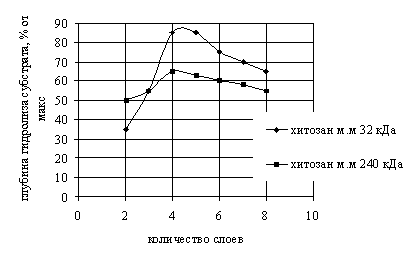
Рис. 2. Глубина гидролиза субстрата иммобилизованным
трипсином в зависимости от количества слоев полиэлектролитов (рН=7,5, время
инкубации 180 мин)
Глубина гидролиза
казеина трипсином, иммобилизованным в двухслойную микрокапсулу, содержащую
низкомолекулярный хитозан, составила 34 %, высокомолекулярный – 50 %. При
увеличении числа полиэлектролитных слоев в мембране до 4 глубина гидролиза
субстрата иммобилизованным ферментом достигает своих максимальных значений: 85
% (низкомолекулярный хитозан) и 64 % (высокомолекулярный хитозан).
При дальнейшем
увеличении числа слоев полисахаридов глубина расщепления казеина трипсином
постепенно падает, что, вероятно, связано с уплотнением оболочки микрокапсул,
затрудняющим взаимодействие фермента с субстратом.
Совокупность полученных данных
свидетельствует об эффективности иммобилизации трипсина в ПЭМК, сформированные
биосовместимыми и биодеградируемыми полимерами. Включение фермента в ПЭМК обеспечивает
значительное сохранение их активности, стабилизацию и пролонгированное действие.
Литература:
1. Вудворд, Дж. Иммобилизованные клетки и ферменты [Текст] / Дж. Вудворд – М.:
Мир, 1988, 215 с.
2. Каплун, А. П. Липосомы и другие наночастицы как средство
доставки лекарственных веществ [Текст] / А. П. Каплун, Шон Ле Банг,
Ю. М. Краснопольский // Вопр. мед. химии. – 1999.– Т. 45. – №1. – С.3–13.
3.
Trubetskoy, V. S.
Layer-by-Layer deposition of oppositely charged polyelectrolytes on the surface
of condensed DNA particles [Text] / V. S. Trubetskoy, J. E. Hangstrom,
V. G. Budker, J. A. Wolff // Nucl. Acid Res. –
1999. – Vol. 27(15). – P. 3090–3095.
4.
Sukhorukov, G. B.
Microencapsulation by means of step-wise adsorbtion of polyelectrolytes [Text] /
G. B. Sukhorukov, S. Moy, A. S Susha // Microencapsulation. –
2000. – Vol. 17(2). – P. 177–185.
5.
Berth, G. Polyelectrolyte
complex and layer-by-layer capsules from chitosan/chitosan sulfate [Text] / G.
Berth, A. Voigt, H. Dautzenberg, E. Donath, H. Mohwald // Biomacromolecules. –
2002. – Vol. 3(3). – P. 579–590.
6. Включение белков в полиэлектролитные микрочастицы путем
послойной адсорбции полиэлектролитов на агрегатах белка [Текст] / Д. В.
Володькин, Н. Г. Балабушевич, Г. Б. Сухоруков, Н. И. Ларионова // Биохимия. – 2003.– Вып. 2(68). – С. 283–289.