Биологические науки/9 Биохимия и биофизика
к.т.н.
Шеламова С.А.1, д.т.н. Тырсин
Ю.А.2
Воронежский
государственный университет инженерных технологий, Россия
Московский
государственный университет пищевых производств, Россия
стабильность липазы Rh. oryzae 1403
в органических средах
Проведение реакций в водной среде было
связано с представлением, что органический растворитель инактивирует ферменты.
Как выяснилось, это не только упрощенное, но и неправильное понятие [1].
Действие ферментов в неводных средах не ограничивается экспериментом. Множество
ферментов в живых клетках, к ним прежде всего относятся липазы, функционируют в
гидрофобном окружении. Что касается биотехнологии, это очень важно, так как ферментативный
катализ в неводных средах существенно расширяет возможности индустриального
биокатализа. Благодаря многочисленным исследованиям стало ясно, что
липолитические ферменты в зависимости от источника сильно отличаются отношением
к виду растворителя и минимальным количеством воды, необходимой для проявления
активности.
Цель настоящей работы состояла в изучении
стабильности липазы Rhizopus oryzae 1403
в средах с органическими растворителями. Для этого были выбраны растворители с
различной полярностью. Это метанол, этанол, изопропанол, бутанол, ацетон – водосмешивающиеся
полярные с log P<1,0. И хлороформ, гексан, гептан, изооктан –
липофильные неполярные с 2<log P<5.
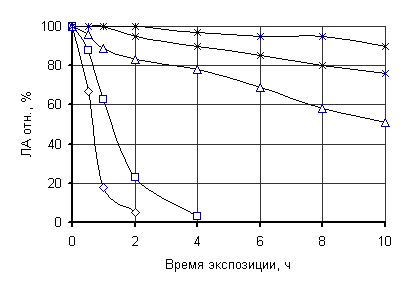
Как показали
исследования (рисунок), гидрофильные растворители в разной степени подавляют
активность липазы Rh. oryzae 1403.
В присутствии метанола она быстро и резко падает. Лучшим растворителем из этой
группы был бутанол – с большим значением log P. Многие
исследователи находят объяснение этого явления в том, что водосмешивающиеся
растворители деформируют микрослой воды, находящийся на поверхности молекулы фермента.
Однако строгой корреляции между log P и сохранением активности липазы Rh. oryzae 1403 не наблюдалось.
а
б
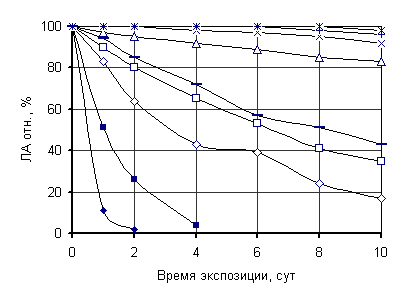
Рисунок. Стабильность (а) растворимой и
(б) иммобилизованной липазы при инкубации в органических растворителях при 35
ºС: (♦) метанол, (◊) этанол, (□) ацетон, (■) хлороформ,
() изопропанол; (∆) бутанол, (○) гексан, (+) гептан, (*)
изооктан
В литературе есть
сведения о том, что действие растворителей с различной полярностью трудно
предсказать для всех ферментов. Например, у панкреатической липазы колебания в
этой зависимости наблюдались в интервале -0,5<log P<2,8, у
грибной – 1,0<log P<1,9. Дрожжевая липаза показала более строгую
корреляцию, хотя некоторые отклонения замечены в интервале log P 2–4
[548].
Полярные растворители хорошо сохраняли
каталитическую активность липазы Rh. oryzae 1403,
что согласуется с данными в литературе и что объясняют их неспособностью
удалять воду, необходимую для проявления действия фермента [549]. Хлороформ
сильно снижал активность. Подобный эффект наблюдали у липазы из Rh. oryzae АТСС 24563, связанной с мицелием [230]. Влияние
галоалканов связывают с увеличением степени спирализации в третичной структуре
белка [546].
Иммобилизованный препарат отличался более
высокой устойчивостью в органических средах. Полярные растворители (этанол,
ацетон, изопропанол) вызывали инактивацию растворимой липазы при 35 ºС за
0,5–2 ч, с то время как у иммобилизованной формы остаточная активность после 10
сут инкубации составляла 17–43 %. В неполярных растворителях (изооктан, гептан,
гексан) она оставалась на уровне 98–95 % за тот же период.
Литература:
1. Dordick, J. S. Desinging enzymes for use in organic
solvents [Text] / J. S. Dordick // Biotechnol. Prog. – 1992. – V. 8. – P.
259–267
2. Zaks, A. Enzymatic
catalysis in nonaqueous solvents [Text]
/ A. Zaks, A. M. Klibanov // J. Biolog. Chem. – 1988. – V. 263, № 7. – P.
3194–3201
3. Zaks, A. The
effect of water on enzyme action in organic media [Text] / A. Zaks, A. Klibanov
// J. Biol. Chem. – 1988. – V. 263, № 17. – Р. 8017–8021
4. Essamri, M.
Optimization of lipase production by Rhizopus oryzae and study on the
stability of lipase activity in organic solvents [Text] / M. Essamri, V. Deyris, L. Comeau // J. Biotechnol. –
1998. – V. 60. – P. 97–103
5. Yon, J.
Structure et dinamique conformationnelle des proteins [Text] / J. Yon. – Paris:
Ed. Hermann, 1969. – pp. 160–163