УДК 615.363
Этерификацией
20-гидроксиэкдизона (20Е) избытком ацилирующего агента были синтезированы
2,3,22-триацетат, 2,3,22,25-тетраацетат и 2,3,22-трипальмитат 20Е. При
эквимольном соотношении реагентов был получен 2-ацетат 20Е. По разработанной
нами схеме селективного конъюгирования синтезированы 22-, 25-моноацетаты и 22-моностеарат
20Е.
Исследование
антимикробной активности 20Е и его ацетатов позволило рекомендовать их при совместном
присутствии в составе ранозаживляющих препаратов наружного применения.
Изучение
включения 20Е и его 2,3,22-триацетата, 2,3,22,25-тетраацетата и
2,3,22-трипальмитата в липосомы
на основе фосфилипида яичного лецитина и гидролиза 2,3,22-трипальмита из свободного
конъюгата и из липосом показали перспективность их использования в качестве
лекарственных препаратов пролонгированного действия в фармацевтике, медицине и
косметологии.
Нами синтезирован тройной полимер-полимерный комплекс на
основе хитозана, полиэтиленгликоля и
20Е, что открывает перспективы создания экдистероидсодержащих лекарственных
препаратов ранозаживляющего действия без предварительной модификации 20Е для
внутреннего и наружного применения.
Н. К. Политова,
кандидат химических наук, доцент
(Сыктывкарский
лесной институт)
И. В. Бешлей,
младший научный сотрудник
(Институт биологии КНЦ УрО РАН)
Е.А.Пшунетлева,
кандидат
химических наук, ученый секретарь
(Институт физиологии КНЦ УрО РАН)
Т.И.Ширшова,
кандидат химических наук, ведущий научный сотрудник
(Институт биологии КНЦ УрО РАН)
В.В.Володин,
доктор биологических наук, зав.лаборатории биохимии
и биотехнологии растений
(Институт биологии КНЦ УрО РАН)
ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ НА ОСНОВЕ ФИТОЭКДИСТЕРОИДОВ
Экдистероиды,
представляющие собой полигидроксилированные стероиды, привлекают интерес
исследователей благодаря своей высокой биологической активности. У членистоногих
они регулируют процессы линьки. Физиологическое действие экдистероидов на
млекопитающих обусловлено их свойством стимулировать биосинтез белка при отсутствии
гормонального эффекта [1]. Показана перспектива их использования в составе лекарственных
препаратов адаптогенного, тонизирующего, кардиотропного, противоязвенного и
ранозаживляющего действия.
Важнейшим недостатком
низкомолекулярных и немодифицированных
лекарственных веществ (ЛВ) является их низкий терапевтический индекс. Это означает,
что концентрация, при которой они оказывают лечебное действие, мало отличается
от концентрации, при которой препарат становится токсичным. В других случаях
лекарственный препарат при введении в организм может быстро терять активность
под действием инактивирующих агентов. Преждевременное разрушение, низкая проникающая способность
через клеточную мембрану требуют повышения дозы ЛВ, а значит возрастанию их
вредных побочных реакций на организм. Поэтому все больше ученым приходится
задумываться не столько над поиском новых лекарств, столько над созданием более
совершенных форм уже известных биологически активных препаратов и задачей доставки
этих препаратов в организм, регулировании скорости действия и времени пребывания
в организме. Такие лекарственные препараты получили название «препараты
направленного и пролонгированного действия». Создание таких препаратов возможно
на принципах биомиметики, основанной на моделировании событий, происходящих в
природе.
Цель
нашей работы заключалась в разработке биомиметических принципов конструирования
экдистероидсодержащих лекарственных препаратов.
Кроме свободных экдистероидов из различных
природных источников выделены их производные, главным образом, это конъюгаты с уксусной
и высшими жирными кислотами. Из всех конъюгатов с карбоновыми кислотами наибольший
интерес представляют 22-моноацильные производные пальмитиновой, стеариновой и
олеиновой кислот (гидроксильная группа при С22 является очень важной
для проявления биологической активности). Показано, что они являются
неактивными резервными формами гормона линьки насекомых и запасаются в
органеллах яйцеклеток взрослых самок (свидетельствует об амфифильных свойствах ацильных производных экдистероидов).
Обнаружено, что образование ацильных производных обратимо и в процессе
эмбриогенеза под действием внутриклеточных эстераз происходит высвобождение
активной формы гормона [2]. Использование принципа обратимого конъюгирования
экдистероидов, реализуемого в организме насекомых, представляется нам
перспективным направлением для создания экдистероидсодержащих препаратов
пролонгированного действия.
Путем
введения в состав молекул экдистероидов гидрофобных блоков модификацией высшими
жирными кислотами возможно получение производных с мембранотропными свойствами.
Такие препараты будут обладать возможностью дозированного высвобождения
лекарственного начала и эффективного проникновения в клетки-мишени.
В
связи с крайне низким содержанием коньюгатов в природных объектах (< 0,001
%) их получение методом выделения – процесс трудоемкий. Наиболее простым и
дешевым способом получения конъюгатов экдистероидов является химическая
трасформация доступных фитоэкдистероидов. В нашем случае таковым является
20-гидроксиэкдизон (20Е), содержание которого в растениях достигает 2 %
(масс.).
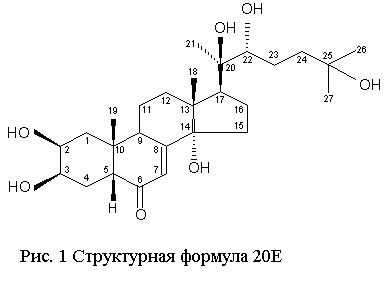
20Е
– полигидроксисоединение (рис. 1), содержащее 6 гидроксильных групп: три вторичных
(при С2, С3 и С22) и три менее
реакционноспособных - ретичных (при С14, С20 и С25). Изучение реакций химической модификации 20Е
позволило выяснить реакционные способности гидроксигрупп к конъюгированию и
расположить их по уменьшению в следующий ряд: 2, 3, 22>25>20>>14.
В этой связи при этерификации избытком
ангидрида или хлорангидрида карбоновых кислот нами были получены
соответствующие три- и тетраэфираты 20Е, а при эквимольном соотношении
уксусного ангидрида и 20Е из смеси полиацетатов был выделен 2-ацетат (таблица
1).
Таблица 1
Условия и результаты ацилирования 20Е
|
Мольное отношение 20Е:АР |
Выход, % |
|||
|
2,3,22,24-тетраацетат |
2,3,22- триацетат |
2-ацетат |
2,3,22- трипальмитат |
|
|
1:100(15) |
63х |
31х |
- |
(75х) |
|
1:1 |
|
|
15хх |
|
Ацилирующие
реагенты: уксусный ангидрид, хлорангидрид пальмитиновой кислоты, ангидрид
стеариновой кислоты
Условия
разделения и очистки: хколоночная хроматография (адсорбент:
силикагель, элюент: метанол в хлороформе – 0÷100%);
ххпрепаративная нормально-фазовая ВЭЖХ
(адсорбент: силикагель, элюент: гексан / изопропанол / вода = 100:40:3 V/V/V).
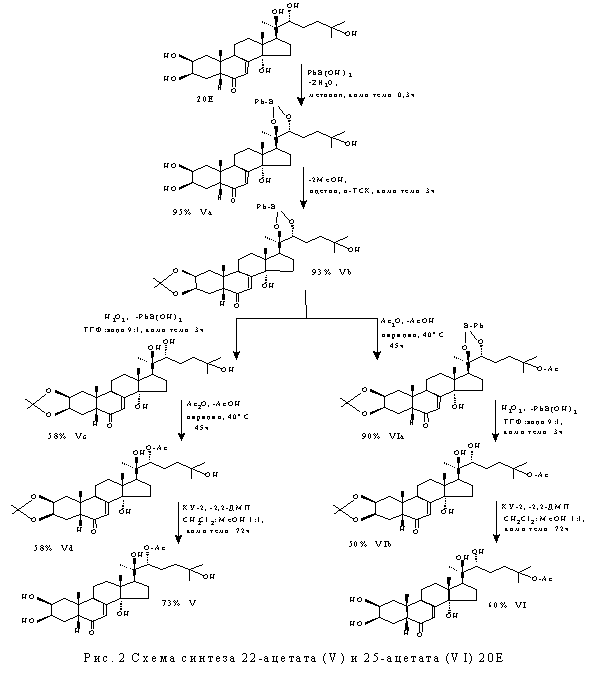
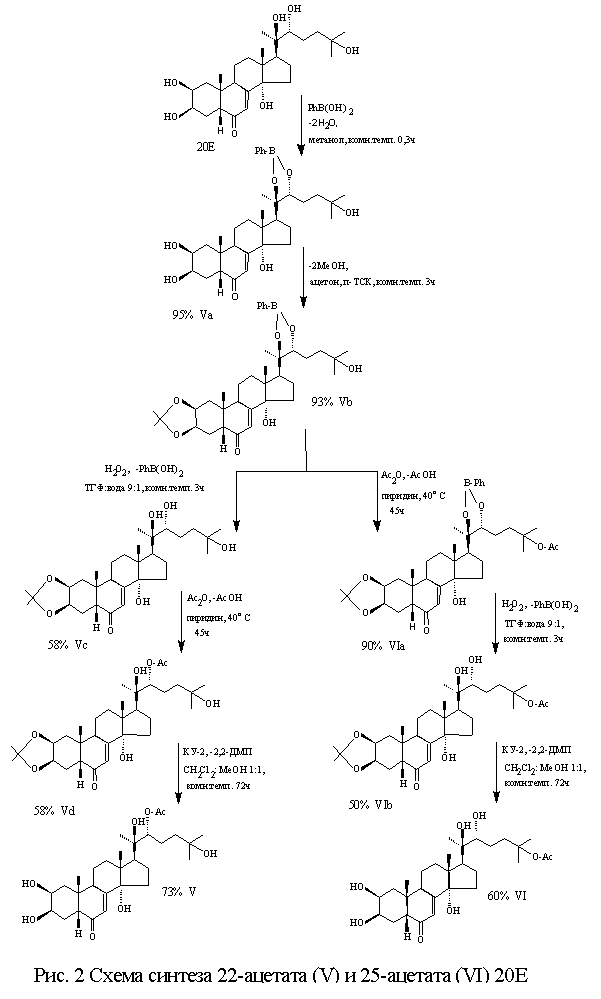
Синтез
моноацильных производных 20Е (особенно в боковой цепи при С22 и С25)
связан с большими трудностями и возможен лишь при использовании эффективных
способов защиты диольных групп. Нами
была разработана пятистадийная схема получения 22- и 25-ацетата 20Е [3],
основывающаяся на защите диола в положении С2/С3 в виде изопропилиденого
производного и диольного фрагмента при С20/С22 - в виде
фенилборатного производного.
По
разработанной схеме был также синтезирован 22-стеарат 20Е. Этапы и условия химической
трасформации 20Е по 22- и 25-положениям представлены на рис 2. Очистка и разделение продуктов реакции
проводили методами колоночной и препаративной НФ ВЭЖХ. Контроль за ходом
реакций и чистотой продуктов осуществляли методами ТСХ и аналитической НФ
ВЭЖХ. Структуры промежуточных
соединений и конечных продуктов были подтверждены методом 1Н
ЯМР-спектроскопии. Выходы моноацильных производных представлены в таблице 2.
Таблица
2
Природа и выходы моноацильных производных
|
Природа моноацильного производного 20Е |
Выход по отношению к исходному 20Е |
|
25-ацетат |
24 |
|
22-ацетат |
22 |
|
22-стеарат |
30 |
С
целью оценки возможности использования 20Е и его ацетатов (2-моноацетата,
2,3,22-триацетата и 2,3,22,25-тетраацетата) в составе ранозаживляющих
препаратов было проведено их тестирование по отношению к широкому спектру
тест-культур микроорганизмов. Антимикробную активность (АМА) определяли в
лаборатории биохимии и биотехнологии микроорганизмов Института микробиологии АН
РМ. Проведенные исследования показали, что свободный 20Е неактивен по отношению
к большинству тест-культур микроорганизмов. Введение же ацетильных групп
приводит к резкому возрастанию АМА. Из 19 тест-культур полное подавление
наблюдалось в 14 случаях, среди которых возбудители воспалительных и гнойных
заболеваний, что позволяет рекомендовать 20Е и его ацетаты при совместном их использовании в ранозаживляющих
препаратах наружного применения.
Другим интересным направлением в создании
лекарственных форм 20Е являются липосомы. Липосомы – закрытые двухслойные сферические структуры,
состоящие из концентрических липидных бислоев, диаметром 110 – 400 нм (рис. 3).
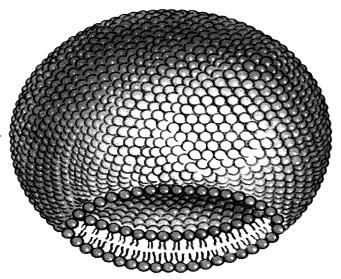

Рис. 3 Строение липосомы
Включение ЛВ в
липосомы может значительно повысить их терапевтическую эффективность, поскольку,
с одной стороны, ЛВ, находящееся в липосоме, защищено ее мембраной от действия
неблагоприятных факторов, а с другой – та же мембрана не позволяет ЛВ превысить
допустимую концентрацию в биологических жидкостях организма. Липосома в данном
случае выполняет роль хранилища, из которого ЛВ высвобождается постепенно, в
нужных дозах и в течение требуемого промежутка времени. С точки зрения биологической
совместимости липосомы идеальны как переносчики лекарственных веществ. Их
получают из природных липидов и поэтому они нетоксичны, не вызывают нежелательных
иммунных реакций и биодеградируемы, т.е. разрушаются под действием обычных
ферментов, присутствующих в организме. В липосомы могут быть включены как гидрофильные,
так и гидрофобные вещества.
Нами были проведены исследования по включению 20Е,
2,3,22-триацетата, 2,3,22,25-тетраацетата и 2,3,22-трипальмитата в липосомы на основе фосфилипида яичного
лецитина (яФХ – яичный фосфатил холил) [3]. Везикулы липосом получали методом
гидратации сухой липидной пленки с последующей обработкой ультразвуком.
Исследуемые экдистероиды в смеси дихлорэтан/метанол (4:1 по объему) добавляли к
лецитину. После получения раствора растворители упаривали в роторном испарителе.
Образование мультиламеллярных везикул (МЛВ) контролировали с помощью световой
микроскопии. Визуализацию липосом осуществляли с помощью окраски суданом черным.
Размеры липосом составили 3-30 мкм. Оптимальными для использования в косметике
и медицине считают липосомы с размерами 100-200 нм (0.1-0.2
мкм), т.к. частицы больших размеров могут закупорить мельчайшие кровеносные
сосуды. Определение размера малых одноламеллярных везикул (МОВ) проводили с
помощью электронной микроскопии. Средний размер липосом с трипальмитатом
составил 83±9 нм и удовлетворяют требованиям, предъявляемым к липосомальным препаратам
в фармацевтике и медицине. Для оценки включения экдистероидов в липосомы
использовали метод гель-хроматографии (Bio-Gel P-2 фирмы Biorad
(США) с размерами пор для разделения веществ с молекулярной массой 100-1800
Да).В таких условиях липосомы не проникают в поры геля, а экдистероиды даже в
случае трипальмитата (М=1194) должны проникать в поры геля. Собранные фракции
анализировали методом НФ-ВЭЖХ.
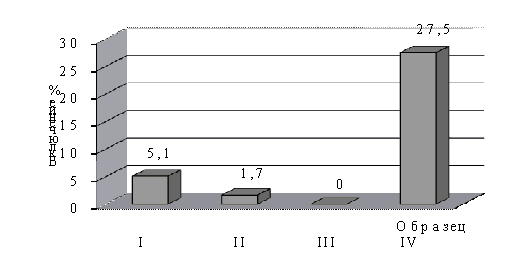 Данные
по включению 20Е и его ацильных производных представлены на рис. 4.
Данные
по включению 20Е и его ацильных производных представлены на рис. 4.
Рис. 4 Включение ацильных
производных 20Е в липосомы
I – липосома с 20Е;
II – липосома с 2,3,22-триацетатом
20Е;
III –
липосома с 2,3,22,25-тетраацетатом 20Е;
IV - липосома с 2,3,22-трипальмитатом 20Е.
Полученные данные свидетельствуют о том, что исследованные экдистероиды
включаются во внутреннее водное пространство липосом. Таким образом, для
повышения сродства экдистероидов к липидному бислою липосом недостаточно просто
гидрофобизировать молекулы 20Е, необходимо ввести в состав его молекулы
мембранотропный фрагмент оптимального размера, чтобы добиться эффективного
встраивания экдистероидов в липосомную мембрану. Включение 2,3,22-трипальмитата
20Е в липосомы в 5.4 раза больше по сравнению с 20Е. Для разработки
липосомальных препаратов необходимо определить оптимальное соотношение
липид/субстрат, при котором содержание субстрата в липосомах максимально, а
потери БАВ во время формирования липосом минимальны. Содержание трипальмитата в
липидном бислое максимально (1.8 мол.%) при его содержании в исходной смеси 19.2
мол.%. Проведено исследование гидролиза 2,3,22-трипальмитата в свободном
виде и включенного в липосомы с помощью
панкреатической липазы (таблица 3).
Таблица 3
Результаты гидролиза 2,3,22-трипальмитата
|
Состояние конъюгата |
Выход 20Е, % |
|
Свободный |
68 |
|
В составе липосомы |
14 |
Выход 20Е из свободного конъюгата составил – 68%, из
липосом – 14%, что подтверждает пролонгирующий эффект лекарственных препаратов
в липосомальной форме.
Липосомальные
экдистериодсодержащие лекарственные формы перспективны при лечении заболеваний
и ожогов кожи.
Еще
одним из перспективных направлений создания лекарственных препаратов направленного
и пролонгированного действия является использование полимер-полимерных
комплексов (ППК) с низкомолекулярным биологически активным веществом (БАВ), например
20Е или его ацильных производных.
ППК
представляют особый класс полимерных веществ, образующихся в результате
взаимодействия различных по природе функциональных групп макромолекул
(основного и кислотного характера). Полимерные комплексы образуются в
результате кооперативных обратимых реакций за счет образования солевых или
водородных связей, что придает ППК очень высокую стабильность в широком
интервале рН. Макромолекулы комплементарны друг другу, поэтому взаимодействие между
ними в термодинамическом аспекте вполне аналогично взаимодействию между
биополимерами, происходящими в живой природе и лежат в основе физиологической
активности природных лекарственных препаратов [4].
Простейший
способ получения ППК – смешение водных растворов различных по природе
полимеров. Образование ППК происходит в результате очень быстрой обратимой
реакции. Процесс заканчивается практически мгновенно даже при очень больших
разбавлениях. В зависимости от мольного отношения функциональных групп и
молекулярных масс полимеров могут быть получены как водорастворимые, так и
нерастворимые ППК. Первые представляют интерес для создания новых транспортных
форм доставки БАВ и возможности использования таких лекарственных препаратов
для внутреннего применения (перорально). Тогда как нерастворимые ППК могут
найти применение для получения пленочных материалов для наружного применения
при лечении ран.
Пролонгированное
высвобождение низкомолекулярной основы в отсутствии ковалентной связи из ППК
происходит за счет диффузии низкомолекулярного БАВ в окружающую среду из
набухшей полимерной системы и определяется природой используемых полимеров, их
молекулярной массой, эффективностью взаимодействия друг с другом и ЛВ, а также
природой окружающей среды [5].
Наш
интерес к ППК обусловлен открывающимися перспективами создания экдистероидсодержащих
лекарственных препаратов ранозаживляющего действия без предварительной
модификации 20Е, дозированное поступление ЛВ может быть достигнуто варьированием
природой и молекулярной массой используемых полимеров.
Наиболее
перспективными при создании полимерных лекарственных препаратов являются
природные полимеры – хитозан, микрокристаллическая целлюлоза, коллаген, альгинаты
и другие. Широкое применение природных полимеров обусловлено их биосовместимостью,
способностью к биодеградации, низкой токсичностью. При использовании природных
полимеров благодаря их собственной физиологической активности может быть
реализован синергический эффект – усиление активности лекарственной основы.
Нами
проведены исследовательские работы по получению и характеристике ППК на основе
хитозана (природный полимер – аминоглюкан, степень деацелирования 75 %, средняя
молекулярная масса равна 1800) и полиэтиленгликоль - ПЭГ (синтетический
полимер, средняя молекулярная масса равна 40000) при использовании в качестве
низкомолекулярного БАВ – 20Е.
Двойные
ППК (ДППК) получали простым смешиванием растворов полимеров (ПЭГ в воде,
хитозан в ацетатном буфере) в эквимольном соотношении (концентрации растворов
0.01 н в пересчете на мономерное звено).
Тройные
ППК (ТППК) получали по следующей схеме: навеску 20Е помещали в раствор хитозана
и после ее растворения приливали раствор ПЭГ. В обоих случаях образовались
раствормые ППК. Тонкие пленки комплексов на микросетке с подложкой из пористого
углерода (для негативного контрастирования – для визуализации глобул
комплексов) изучали методом трансмиссионной электронной микроскопией (рис. 5).
Размеры
глобул ДППК составили от 0.2 до 0.4 мкм, размеры глобул ТППК – от 0.8 до 1.2 мкм.
Для определения степени включения 20Е в комплекс ТППК
переводили в нерастворимую форму при действии раствора гидроксида натрия.
Концентрация 20Е в фильтрате по данным ОФ ВЭЖХ составила 35-25 %. Таким
образом,
степень включения 20Е в ППК
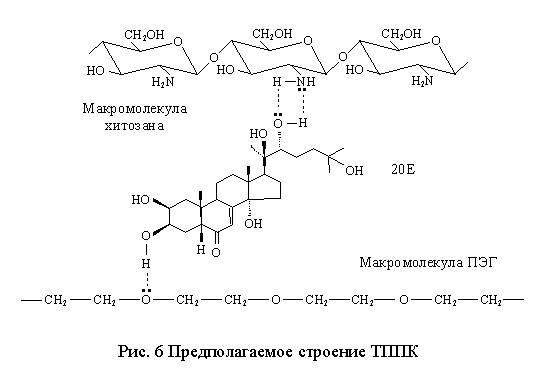
составила 65-75 %. Предполагаемая структура ТППК представлена на рис. 6. Включение
20Е и его ацильных производных в нерастворимые ППК расширяет области их
применения в качестве трансдермальных препаратов.

Библиографический список
1.
Slama
R., Lafont R. Insect hormones – ecdysteroids: their presence and action in
vertebrates // Eur. J. Entomol., 1995. – Vol. 92. – P. 355-377.
2.
Koolman
J. Ecdysteroids // Zool. Science, 1990. – Vol. 7. – P. 563-580.
3.
Фитоэкдистероиды. – СПб.: Наука, 2003. – 293 с.
4. Кабанов В.А. Физико-химические основы и перспективы применения растворимых интерполиэлектролитных комплексов (обзор) // Высокомолек. соед. – 1994. – Т. 36. - № 2. – С. 183-197.
5. Новый подход к созданию материалов с контролируемым выделением лекарственных веществ / Н.Р.Кильдеева, В.Г.Бабак, Г.А. Вихорева и др. // Вестн. МГУ. – Серия 2. – Химия. – 2000. – Т. 41. - № 6. – С. 423-425.