Фазылов С.Д.1, Нуркенов О.А.1, Амерханова Ш.К.2,
Толепбек И.С.2, Аринова А.Е.1
1ТОО «Институт органического синтеза и
углехимии Республики Казахстан»,
2Карагандинский государственный университет им. Е.А. Букетова,
Караганда, Казахстан
НОВЫЕ
СТИРИЛПРОИЗВОДНЫЕ НА ОСНОВЕ
4-(4-МЕТОКСИФЕНИЛ) 6-МЕТИЛ –
2-ТИОКСО-1,2,3,4-ТЕТРАГИДРОПИРИМИДИН –
-5-КАРБОКСИЛАТОВ
Пиримидиновый структурный фрагмент входит в состав ряда природных соединений, таких как нуклеиновые кислоты, витамин В6, синтетических лекарственных средств (барбитуратов, монастрола, нифедипина), химиотерапевтических препаратов (фторурацила) [1-2].
Структура 4-арил-3,4-дигидропиримидин-2-тиона
представляет интерес для изучения реакционной способности молекулы и получение
новых производных. Атомы водорода СН3 группы в 6-положении молекулы 4-(4-метоксифенил)-6-метил-2-тиоксо-1,2,3,4-тетрагидропиримидин-5-карбоксилата
обладает доста- точной подвижностью к реакциям конденсации. В связи с этим представлял
интерес осуществить синтез и изучить строение новых стирилпроизводных
3,4-дигидропиримидин-2-тионов (1-3).
Синтез
соединений (1-3) был осуществлен конденсацией 4-(4-метоксифенил)-6-метил-2-тиоксо-1,2,3,4-тетрагидропиримидин-5-карбоксилата
с замещенными ароматическими альдегидами (4-метоксибензальдегид, о-хлорбензальдегид,
п-нитробензальдегид) в среде этилового спирта в присутствии каталитического
количества пиридина.
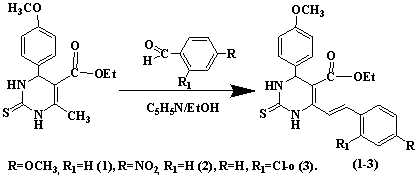
Синтезированные стирилпроизводные
4-(4-метоксифенил)-6-метил-2-тиоксо-1,2,3,4-тетрагидропиримидин-5-карбоксилатов
(1-3) представляют собой белые порошки,
растворимые в полярных растворителях.
В спектрах ЯМР1Н стирилпроизводных 4-(4-метоксифенил)-6-метил-2-тиоксо-1,2,3,4-тетрагидропиримидин-5-карбоксилатов (1-3) наблюдается отсутствие синглета метильной
группы и появление дополнительных мультиплетов 6,90-7,90 м.д., присущих
ароматическим и виниловым протонам стирильной группы. Так, в ЯМР1Н-спектре
соединения (1) в области сильного поля
при d 1,12 м.д. в виде триплета резонируют протоны
метильной группы этокси-группы, а метиленовые протоны этой группы прописываются
в виде квартета в области d 4,05 м.д. (рисунок 1). В области
4,72 и 4,88 м.д. прописываются два интенсивных синглета, характерные для двух
метокси-групп ароматических колец. Ароматические a и b протоны двух фенильных колец
выписываются в области 6,90 и 7,13 м.д. в виде двух дублетов соответственно.
Сигнал протона С (4)-Н находится в области 5,12 м.д. в виде дублета. В области
слабого поля при 7,86 и 7,88 м.д. резонируют винильные протоны в виде двух
дублетов. Протоны N(1)-Н и N(3)-Н выписываются при 10,35 и 9,56 м.д.
соответственно в виде двух синглетов.
Таким образом, конденсация
ароматических альдегидов с 4-(4-метоксифенил)-6-метил-2-тиоксо-1,2,3,4-тетрагидропиримидин-5-карбоксила-
том приводит к образованию новых стирилпроизводных
3,4-дигидропиримидин-2-тионов, которые являются весьма перспективными
соединениями в плане изучения их биологических свойств.
Экспериментальная часть
Спектры
ЯМР 1Н записаны на
спектрометре Bruker DRX500 с
частотой 500 МГц в растворах CDCl3, DMSO-d6
относительно внутреннего стандарта ТМС (погрешность измерений ±0,05 м.д.).
Температура плавления определена на приборе "Boetius"
(погрешность измерений ±0,1оС). ТСХ анализ
выполнен на пластинках "Silufol UV-254" и «Sorbfil», проявление парами йода.
Этил
4-(4-метоксифенил)-6-(4-метоксистирил)-2-тиоксо-1,2,3,4-тетра- гидропиримидин -
5-карбоксилат (1). 0,5 г (0,0016
моль)
4-(4-метокси-фенил)-6-метил-2-тиоксо-1,2,3,4-тетрагидропиримидин-5-карбоксилат
раство- ряют в горячем этаноле, к нему приливают 0,21 г (0,0016 моль) анисового
альдегида. К смеси добавляют несколько капель пиперидина и кипятят 7-8 часов с
обратным холодильником. Ход реакции контролировали по ТСХ (тонкослойная
хроматография). После охлаждения стали выпадать кристаллы. Выпавшие кристаллы
фильтруют и сушат. Выход 0,52г (42,6%), t пл.=98-101°С, Rf=0,53
(этилацетат-гексан (1:1)). Вычислено, %: C
65.07; H 5.70; N 6.60. C23H24N2O4S.
Найдено, %: C 65.28; H 5.88; N 6.82.
Этил
4-(4-метоксифенил)-6-(4-нитростирил)-2-тиоксо-1,2,3,4-тетрагид- ропиримидин
-5-карбоксилат (2) был получен аналогично соединению (1). Выход 0,38 г (54,3%), t пл.=150° С, Rf=0,5 (этилацетат-гексан (1:1)). Вычислено, %: C 60.12; H 4.82; N 9.56. C22H21N3O5S. Найдено, %: C 60.23; H 4.97; N 9.83.
6-(2-хлоростирил)-4(4-метоксифенил)-2-тиоксо-1,2,3,4-тетрагидропи -римидин-5карбоксилат (3) был
получен аналогично соединению (1) и (2). Выход 0,29 г (54,3%), t пл.=154-155°С, Rf=0,53
(этилацетат-гексан (1:1)). Вычислено, %: C 61.60; H 4.93; N 6.53. C22H21ClN2O3S. Найдено, % C 61.81; H 5,01; N 6.71.
Литература:
1.
Kappe C.O., Shishkin O.V., Uray G. [et al.]. X-Ray Structure, Conformational Analysis, Enantioseparation, and
Determination of Absolute Configuration of the Mitotic Kinesin Eg5 Inhibitor
Monastrol// Tetrahedron. - 2000. - Vol. 56, № 13. - P. 1859 - 1862.
2. Вдовина С.В., Мамедов В.А. Новые возможности классической реакции
Биджинелли // Успехи химии. - 2008. — Т. 77, вып. 12. - С. 1091 -1128.