Ж.Б. Сатпаева, О.А. Нуркенов, С.Д. Фазылов, А.К.
Турсынова
ТОО «Институт
органического синтеза и углехимии РК», Казахстан, г. Караганда
СИНТЕЗ И ПРОТИВОВОСПАЛИТЕЛЬНАЯ АКТИВНОСТЬ
5-(МОРФОЛИНОМЕТИЛ)-1,3,4-ТИАДИАЗОЛ-2(3H)-ТИОНА
Известно, что производные гидразидов и
тиосемикарбазидов являются важными синтонами в синтезе азогетероциклов [1, 2]. Используя разнообразные реагенты и меняя условия
проведения реакции, возможно, направить циклизацию в сторону образования
1,3,4-оксадиазолов, 1,3,4-тиадиазолов или 1,2,4-триазолов. Среди
гетероциклических производных интересную как в химическом, так и в
фармакологическом отношении составляет группа 1,3,4-тиадиазола, являющаяся, по
сути, циклическим аналогом тиосемикарбазонов. В литературе имеются
немногочисленные сведения о подобных циклических соединениях [3-5]. В связи с
этим нами в начале осуществлен синтез калиевая соль гидразинодитиоморфолинилуксусной
кислоты (2) на основе гидразида N-морфолинилуксусной кислоты (1) взаимодействием
его с сероуглеродом в щелочной среде.
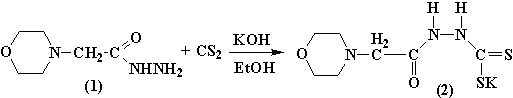
Образующаяся на первой стадии калиевая соль гидразинодитиоморфолинилуксусной кислоты 2 под действием конц. серной
кислоты при пониженной температуре претерпевает циклизацию в 5-(морфолинометил)-1,3,4-тиадиазол-2(3H)-тион (3).
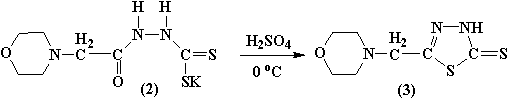
Полученное соединение (3) представляет собой белое кристаллическое вещество с т.пл.=136-1370С, растворимое в полярных органических растворителях. Выход продукта составляет 45%.
В спектре ЯМР1Н соединения
5-(морфолинометил)-1,3,4-тиадиазол-2(3H)-тиона (3) сигналы метиленовых протонов морфолинового фрагмента прописываются в
виде двух триплетов в области с центром 2,46 м.д. и 3,57 м.д. Тиоамидный N-Н протон тиадиазольного фрагмента выписывается в области
слабого поля в виде синглета в области 14,38 м.д. Метиленовый
протон >N-CH2 -фрагмента
резонирует при 3,7 м.д. в виде синглета.
Введением в структуру гидразида N-морфолинилуксусной кислоты серы, которые приводит к общему снижению токсичности и появлению других видов биоактивности, мы рассчитывали получить соединения с высокой биологической активностью, в том числе и противовоспалительной.
Изучение противовоспалительной активности
образца 5-(морфолинометил)-1,3,4-тиадиазол-2-тион
(3) на экссудацию показало, что у крыс в опытной группе через три
часа после введения уксусной кислоты объем экссудата были существенно ниже на
47% по сравнению с показателем в контрольной группе и сопоставим по сравнению с
показателем в группе животных, получавших диклофенак натрия. Результат
исследования противовоспалительной активности образца (3) приведен в таблице.
Таблица
Противовоспалительная активность
Влияние соединения (3) и
диклофенака натрия на количество образовавшегося экссудата в брюшной полости
|
Соединение (название) |
Масса Животных, г |
Количество Экссудата, мл |
|
5-(морфолинометил)-1,3,4-тиадиазол-2-тион |
304±9 |
4,47±0,88* |
|
Контроль, n=5 |
289±7 |
8,45±0,89 |
|
Диклофенак натрия, n=5 |
284±8 |
4,05±0,67* |
Примечание: * - р < 0,05 по
сравнению с контролем; # - р < 0,05 по сравнению с группой сравнения (диклофенак
натрия).
Установлено, что соединение 5-(морфолинометил)-1,3,4-тиадиазол-2-тион (3) проявляет выраженную противовоспалительную
активность на модели острой экссудативной реакции.
Таким образом, нами на основе
физиологически активного гидразида
N-морфолинилуксусной кислоты (1) проведена
гетероциклизация в кислой среде калиевой соли гидразинодитиоморфолинилуксусной
кислоты (2) в соответствующий 5-(морфолинометил)-1,3,4-тиадиазол-2-тион
(3).
Экспериментальная
химическая часть
ИК-спектры
сняты на спектрометре с Фурье-преобразователем «AVATAR-320» в таблетках с KBr, спектры
ЯМР 1Н записаны на
спектрометре Bruker DRX 500 с частотой 500 МГц в растворе DMSO-d6 относительно внутреннего
стандарта ТМС. Температуры плавления определены на приборе «Boetius». Контроль
за ходом реакции и чистотой полученного соединения осуществляли методом
тонкослойной хромотографии на пластинках «Sorbfil» в системе изопропиловый спирт-бензол-аммиак,
10:5:2, проявление парами йода. ![]()
Калиевая соль
гидразинодитиоморфолинилуксусной кислоты (2). Смесь 1,59 г (0,01 моль) гидразида морфолинилуксусной
кислоты (1), 0,84 г (0,015 моль) гидроксида калия растворяют в 15 мл безв. этанола и при охлаждении прикапывают
1,52 г (0,02 моль) сероуглерода. Реакционную смесь перемешивали в течении 2-3
часов. Выпавший порошкообразный продукт отфильтровывают, промывают несколько
раз безводным диэтиловым эфиром. Получают 2,27 г (83%) калиевой соли гидразинодитиоморфолинилуксусной кислоты
(2) с т.пл. 212-214оС.
5-(Морфолинометил)-1,3,4-тиадиазол-2-тион
(3). 1,36 г (0,5 моль) калиевой соли
гидразинодитиоморфолинилуксусной кислоты (2) растворяют порциями в 3 мл охлажденной до 0 0С конц. серной кислоты. Полученный раствор приливают к 50 мл ледяной воды и доводят до нейтральной среды.
Продукт реакции экстрагируют этилацетатом. После сушки над прокаленным поташом
и отгонки растворителя получают 0,97 г (45%) продукта (3) с т. пл. 136-137 оС (этанол).
Экспериментальная биологическая часть
Острую экссудативную реакцию (перитонит)
вызывали внутрибрюшинным введением 1% раствора уксусной кислоты в объеме 1 мл
на 100 г массы тела крыс. Через 3 часа животных забивали, вскрывали брюшную
полость, собирали экссудат и оценивали его объем [6]. Исследуемые объекты
изучали в дозе 100 мг/кг при пероральном введении в виде крахмальной суспензии.
Препарат сравнения диклофенак натрия изучали в дозе 25 мг/кг. Контрольные
животные получали эквиобъемное количество крахмальной слизи. Исследуемые
объекты вводили однократно за 1 час до введения 1% раствора уксусной кислоты.
Статистическая обработка результатов проводилась с использованием пакета
программ «Statistica 6,0». Полученные
результаты представлены в виде «среднее значение стандартная ошибка среднего
значения». Межгрупповые отличия оценивали непараметрическим критерием Mann-Whitney
U-test.
Достоверными считались различия при достигнутом уровне значимости р < 0,05
[7].
Литература:
1. Эльдерфильд Р. Гетероциклические соединения. М.:
Издательство иностранной литературы, 1961. Т. 5. С.88-89.
2. Несынов
Е.П., Греков А.П. Химия производных 1,3,4-оксадиазола // Успехи химии. 1964. Т.
33. № 10. С. 1184.
3. Овсепян Т.Р.,
Диланян Э.Р., Енгоян А.П., Мелик-Оганджанян Р.Г. Синтез производных 1,2,4-триазолов и 1,3,4-тиадиазолов // Химия
гетероциклических соединений. 2004. № 9. С. 1377-1381.
4.
Mamolo M.G., Vio L., Banfi E. // Farmaco. 1996. V. 51. № 1. Р. 71-74.
5. Орлинский М.М. Препаративный
метод синтеза N-производных 2-тиоксотиазолидин-4-она// Журнал
органической химии. 1996. Т. 32. № 1. С. 144-145.
6. Хабриев Р.У. Руководство по экспериментальному
(доклиническому) изучению новых фармакологических веществ. М.: Медицина, 2005.
832 с.
7. Лакин Г.Ф. Биометрия, М.:Высшая школа,
1980. С. 293.