д.м.н.
Кручинина М. В., д.м.н. Шварц Я.Ш., к.м.н. Громов А.А., Баум В.А.,
Федеральное
государственное бюджетное учреждение «Научно-исследовательский
институт терапии и профилактической медицины»
СО РАМН, г.
Новосибирск, Россия
д.т.н.
Генералов В.М., д.т.н. Сафатов А.С., Буряк Г.А.,
Государственный научный центр вирусологии и
биотехнологии “Вектор” Федеральной службы по надзору в сфере защиты прав
потребителей
и благополучия человека, п. Кольцово, Новосибирская
область, Россия
к.х.н.
Кручинин В. Н., к.т.н. Рыхлицкий С.В.
Институт
физики полупроводников им. А.В. Ржанова СО РАН, г. Новосибирск, Россия
Изучение воздействия наночастиц на
структурно-функциональные характеристики эритроцитов человека
Широкий спектр наноматериалов и наночастиц
с различными физико-химическими свойствами может оказывать различное действие
на организм.
Проведенные ранее исследования [1]
позволили установить, что амплитудно-частотные характеристики клетки в
неоднородном переменном электрическом поле являются хорошим индикатором
физико-химических свойств ее мембраны и цитоплазмы, а также отражают состояние
ее биологической активности. Воздействие наночастиц на клетки крови может
привести к изменению их электрических и вязкоупругих параметров, которые
являются «маркерами» состояния клетки и отражают наличие токсического
воздействия.
Цель работы - изучение абсорбционных свойств и воздействия
наночастиц на структурно-функциональные характеристики клеток человека (на
примере электрических и вязкоупругих параметров эритроцитов).
Материалы
и методы.
Исследование токсичности
наночастиц на эритроциты осуществляли с помощью электрооптической системы
детекции клеток (ЭОСДК) [1]. Основные параметры, получаемые с помощью ЭОСДК,
представлены в таблице 1.
Таблица 1. Основные и вспомогательные характеристики
клеток, измеряемые ЭОСДК.
|
N |
Наименование параметра |
Примечание |
|
1 |
r – радиус клетки |
Экспериментально
измеряемая величина |
|
2 |
v – скорость поступательного движения клетки относительно электродов |
Экспериментально
измеряемая величина |
|
3 |
Am – максимальная амплитуда деформации клетки |
Экспериментально
измеряемая величина |
|
4 |
хi – мгновенная амплитуда деформации клетки |
Экспериментально
измеряемая величина |
|
5 |
αc –поляризуемость клетки |
Расчетная
величина |
|
6 |
с – обобщенная жесткость клетки |
Расчетная
величина |
|
7 |
ηc – обобщенная вязкость клетки |
Расчетная
величина |
|
8 |
d – дипольный момент клетки |
Расчетная
величина |
|
9 |
q
– индуцированный заряд |
Расчетная
величина |
|
10 |
fр – равновесная частота клетки |
Экспериментально
измеряемая величина |
|
11 |
Cм – емкость клеточной мембраны |
Расчетная
величина |
Методом диэлектрофореза
в измерительной ячейке исследованы три образца: нативные эритроциты человека;
эритроциты человека, обработанные наночастицами кристаллического диоксида
титана (анатаз) и эритроциты человека, обработанные наночастицами аморфного диоксида
титана.
Для проведения
исследований кровь
объемом 2 мл
забирали вакутейнерами в 3,7% цитратный буфер в соотношении 9:1, через 1 час кровь вносили в 0.3 М раствор
сахарозы (рН 7,36) в соотношении 1:30. В первом образце
сразу после разведения нативных эритроцитов
производились измерения. Во втором и третьем образцах к 2,5 мл взвеси
эритроцитов в сахарозе добавляли 200 мкл кристаллического и аморфного диоксида
титана. Исследования в измерительной ячейке проведены после экспозиции с
различной относительной концентрацией наночастиц в течение 5 мин.
В измерительной ячейке на клетки
воздействовали неоднородным переменным электрическим полем (НПЭП) со следующими
параметрами: напряженность электрического поля 105В/м, градиент напряженности электрического
поля 1011В/м2,
частотный диапазон 10 - 106 Гц.
Результаты
и обсуждение.
Наночастицы
TiO2 адсорбируются
на поверхности мембраны эритроцита и модифицируют ее. В результате
взаимодействия наночастиц TiO2 с эритроцитами происходит изменение формы клеток,
возрастает количество трансформированных эритроцитов, повышается их склонность
к гемолизу. Уровень деформированных эритроцитов, % гемолиза клеток коррелируют
с концентрацией наночастиц TiO2 (r=0,74, p<0,02; r=0,65, p<0,033, соответственно).
Наблюдение
диэлектрофореза проводили в частотном диапазоне от 10 до 106 Гц. Для
всех трех образцов в диапазоне частот 4∙105ё106 Гц наблюдалось движение клеток в
сторону ближайшего электрода (положительный диэлектрофорез). Достоверных
различий между препаратами в этом частотном диапазоне выявлено не было. В
диапазоне частот 105ё4∙105 Гц во всех трех образцах
поступательное движение клеток отсутствовало, наблюдались лишь незначительные
колебания эритроцитов. В диапазоне частот 103ё105 Гц для всех трех препаратов наблюдался
отрицательный диэлектрофорез (движение клеток от ближайшего электрода),
затухавший с дальнейшим снижением частоты.
В диапазоне частот 50ё120 Гц для препарата нативных эритроцитов наблюдался
положительный диэлектрофорез умеренной интенсивности, но все же отчетливо
наблюдаемый (Рис. 1). Данный эффект наблюдался исключительно для нативных
эритроцитов; клетки, подвергшиеся действию наночастиц, не проявляли в этом
диапазоне никаких признаков поступательного движения.
Анализ
амплитудно-частотной зависимости поляризуемости эритроцитов позволяет
предположить, что наночастицы диоксида титана после адсорбции на поверхности
мембраны увеличивают ее проводимость.
I=Iкл
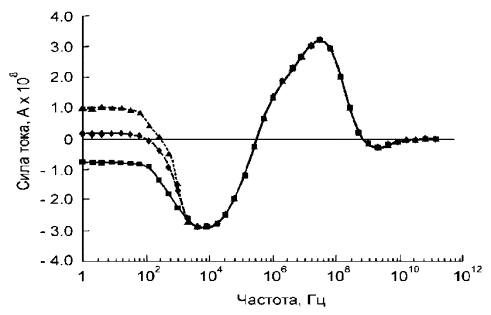
Рис.1. Амплитудно - частотная зависимость поляризуемости
эритроцитов. ▲- интактные эритроциты, ♦ - эритроциты +аморфные
наночастиц TiO2,
g - эритроциты
+ наночастиц TiO2 в форме анатаза.
Результаты анализа токсического действия аморфных
наночастиц TiO2 на эритроциты представлены в таблице 2.
Таблица 2. Результаты анализа токсического действия аморфных
наночастиц TiO2 на эритроциты.
|
Нано-частицы |
Относительная концентрация |
Искажение мембраны |
Изменение формы |
Появление патологичес-ких форм |
Гемолиз |
|
TiO2 |
1 |
+ |
+ |
+ |
- |
|
10 |
+ |
+ |
+ |
- |
|
|
50 |
+ + |
+ + + |
+ + |
+ |
|
|
100 |
+ + + |
+ + + |
+ + + |
+ |
« - » ≈ отсутствие изменений;
« + » ≈ 25% изменений;
« + » ≈ 50% изменений;
« + + » ≈ 75% изменений;
« + + + » ≈ 100% изменений.
Литературные источники, посвященные
токсичности наночастиц, разноречивы: результаты ряда исследований
свидетельствуют о наличии токсичности, другие авторы опровергают эти данные.
Например, о невысокой степени токсичности наночастиц TiO2
свидетельствуют результаты исследования с клетками дыхательных путей in vitro. Клетки обрабатывались промышленными наночастицами Al2O3, CeO2, Fe2O3, NiO, SiO2, TiO2 или частицами грунтовой пыли того же размера.
Показано, что наночастицы промышленных оксидов металлов не столь высокотоксичны
по отношению к легочным клеткам, как частицы пыли окружающей среды [2, 3]. Из
литературных данных также следует, что, вопреки ожиданию, наночастицы не более
токсичны, чем частицы микронного размера [3]. Наночастицы TiO2, CeO2 и ZnO
показали практически одинаковую токсичность и в исследованиях, проведенном на
рыбах [4].
Следует,
однако, иметь в виду, что TiO2 может существовать в различных кристаллических формах,
которые, в свою очередь, могут по-разному взаимодействовать с лигандами и
проявлять различную токсичность по отношению к клеткам. Кристаллические формы
наночастиц существенным образом зависят от способа их получения. По данным
исследований, при проведении гидролиза в водных растворах различных прекурсоров
двуокиси титана (алкоголятов и неорганических солей титана, главным образом, TiCl4) первичными
продуктами гидролиза при низких значениях рН (2-6) являются основные соли
переменного состава [5]. При более высоких рН
образуются гидратированные формы титана. По вопросу о природе гидратированных
форм единое мнение отсутствует: одни исследователи приписывают им формулу TiO(OH)2,
другие – TiO2·nH2O, где n зависит от
условий старения и сушки. Это, вероятно, свидетельствует о неустойчивости
гидроксида титана Ti(OH)4, вследствие чего образуются менее
гидратированные его формы, отличающиеся по степени токсического воздействия на
клетки.
Таким
образом, в исследованиях цитотоксических свойств наночастиц диоксида титана
следует учитывать различие кристаллических форм, которые могут оказывать
различное влияние на клетки. Следует учитывать присутствие гидратированных форм
диоксида титана, которые, могут обладать особыми биологическими свойствами.
Пилотные
эксперименты, выполненные в рамках данной работе, показывают, что можно сделать
предварительный вывод о токсичности наночастиц оксида титана по отношению к
эритроцитам. Вместе с тем, токсичность оказалась отложенной во времени.
Контрольные «нативные» эритроциты явно отличались по форме от
экспериментальных. Однако, сделать уверенные выводы о токсичности исследованных
наночастиц мешает отсутствие их характеризации по среднему диаметру,
среднеквадратичному отклонению диаметра (размера), концентрации в единице
объема, химическому составу, стабильности в водном растворе. Каждый вид
наночастиц следует классифицировать как по физическим свойствам, так и по химическому
составу. Характеризация наночастиц по вышеуказанным параметрам представляет
самостоятельную методическую проблему. Причем, важно разработать общепризнанный
утвержденный протокол исследований. Оценивая литературные данные, следует
отметить, что используемые методики подготовки наночастиц для оценки их
токсичности явно не достаточны.
Проведенные пилотные исследования
токсичности наночастиц TiO2 по отношению к эритроцитам позволили сделать следующие
выводы:
1.
Эритроциты являются
адекватной моделью для изучения токсического действия наночастиц.
2.
Наночастицы TiO2 адсорбируются
на мембранах эритроцитов, что приводит к изменению формы клеток, их гемолизу, а
также увеличивает проводимость мембран.
3.
Выявлена зависимость
появления трансформированных форм эритроцитов, гемолиза клеток от концентрации
наночастиц.
4.
Выявлены отличия в поведении клеток в неоднородном переменном
электрическом поле в различных частотных диапазонах, связанные с воздействием
наночастиц TiO2 (области положительного и отрицательного
диэлектрофореза).
5. Следует разработать протокол исследований токсичности
наночастиц, который следует представить научной общественности.
6. Для полного
представления о токсичности наночастиц, возможности использовании наноструктур
в медицине, промышленности и других направлениях необходимы дальнейшие
системные исследования.
Литература
1. Генералов В. М., Кручинина М. В.,
Дурыманов А. Г., Медведев А. А., Сафатов А. С., Сергеев А. Н., Буряк Г. А.,
Курилович С. А., Громов А. А. Диэлектрофорез в диагностике инфекционных и
неинфекционных заболеваний. / Новосибирск: Изд-во «ЦЭРИС». - 2011. - 172 с.
2.
Landsiedel R., Ma-Hock L., Kroll A., Hahn D., Schnekenburger J., Wiench K.,
Wohlleben W. Testing metal-oxide nanomaterials for human safety. // Adv. Mater.
– 2010. – V.22. – P.2601.
3. Шуленбург
М. Наночастицы – крохотные частицы с огромным потенциалом. Возможности и риски.
/ Бонн, Германия: «Федеральное министерство образования и научных исследований
(BMBF)». – 2008. – 245P.
4. Проданчук Н. Г., Балан Г. М.
Нанотоксикология: состояние и перспективы исследований. // Современные проблемы
токсикологии. - 2009. - №3-4. - С.4.
5. Богуславский Л. И. Методы получения
наночастиц и их размерно-чувствительные физические параметры. // Вестник МИТХТ.
– 2010. – Т.5. - №5. – С.3.