Химия и химические технологии.
Фундаментальные проблемы создания новых материалов и технологий.
К.т.н. Игумнов В.С.
Объединенный институт высоких температур РАН.
Проблемы энергосбережения на
трубчатых агрегатах каталитической конверсии природного газа.
Природный
газ используемый для каталитической конверсии состоит на более чем 90% из
метана – СН4. Остальное парафины более высокого порядка. На основании ряда
независимых экспериментов парафины из природного газа при нагреве, после ряда
превращений образуют метан:
C4H10 → C3H8 → C2H6 → CH4 + С2Н2 .
Промышленное получение водорода из углеводородов в
настоящее время является основным. Теоретические и технические исследования
показывают, что других реальных, экономически выгодных методов получения Н2
нет. Химическая формула паровой
конверсии природного газа выглядит так:
СН4 + Н2О = 3Н2 + СО (1).
Реакция (1) является суммарной общего химического
процесса. Это сильно эндотермическая реакция, т.е. для проведения этой реакции
требуется подвести в зону реакции (1) согласно стандартному тепловому
эффекту 6000кДж/кг или ∆Н =
204кДж/моль (для сравнения для кипения воды при нормальных условиях требуется
2300кДж/кг или 41 кДж/моль). Причем для приемлемой для промышленного использования
скорости образования водорода в зоне реакции должна быть не менее 1500К.
Рентабельных материалов для аппаратов, работающих в таком режиме нет. Для
снижения температуры эксплуатации используемых аппаратов и обеспечения
необходимых рабочих параметров для эксплуатации масштабных агрегатов
используется никелевый катализатор. Катализатор представляет собой гранулы в
виде цилиндров или колец Рашига с отверстиями разной формы и размеров. Удельная
адсорбционная поверхность нано пор
катализатора составляет около 60±10 м2 на грамм катализатора. Эквивалентный
диаметр гранулы катализатора составляет от 10 до 50 миллиметров. Состав
катализатора комплексный состоит из ряда специальных минералов с содержанием
окисла никеля до 40%. Эта смесь формируются в гранулы по специальной технологии
и в специальном термическом режиме обрабатывается в восстановительной газовой
атмосфере. Структура монолита гранул катализатора является пористой. Основой
пористой структуры являются нано поры.
Реакция (1) происходит внутри гранулы катализатора. В процессе специальной
обработки гранул катализатора внутри нано пор образуются никелевые нано
дендриты (ННД), т.н. активные центры катализатора, определяющие его активность.
Формула (1) состоит из двух последовательных реакций:
СН4 = С + 2 Н2
(2)
и далее С + Н2О = Н2 + СО (3).
Тепловой эффект реакции (2) ∆Н =78 кДж/моль и
реакции (3) ∆Н =126 кДж/моль. Видно, что для проведения этих реакций
требуется много тепла. Внутри нано пор происходит следующее. Реакция (1) при
температуре 1000К – 1200К (условия работы катализатора) проходит тогда, когда
энергия молекул СН4 и Н2О более 2,03эВ. Таких молекул в реакционной смеси при
названной температуре практически нет (согласно распределению по компонентам
скорости и энергии менее 10-3%), поэтому идет реакция (2) для её
прохождения энергия у молекул СН4 равна 0,81
эВ. По формуле (2) образующийся углерод адсорбируется на никелевых нано
дендритах, разламывает их (в наиболее тонкой части) и между верхней частью
дендрита и его основанием образуется углеродная нано нить (carbon fiber).
Молекулы водяного пара при температуре более 1000К реагируют по реакции (3) с
углеродом нано нитей, образуя водород и окись углерода. Однако реакция (3)
происходит, если энергия молекулы Н2О более 1,22эВ. Молекулярный механизм
катализа состоит в том, что в интервале температур 1000К – 1200К (условия
работы катализатора) молекул Н2О с энергией 1,22эВ мало (не более 1%). Для
осуществления реакции (2) энергия молекул СН4 должна быть 0,81эВ. Поэтому
углеродные нано нити начинают расти и соответственно, увеличивается площадь
взаимодействия углерода с Н2О и соответственно вероятность взаимодействия
сильных энергетически молекул с углеродом.
Когда количество молекул
углерода образовавшихся по реакции (2) сравняется с количеством молекул Н2О,
прореагировавших с углеродом сравняется, то рост нано нитей прекратится.
Однако, если количество СН4 равно количеству Н2О как в стехиометрическом
уравнении (1), то рост нано нитей будет не пропорционально большим, то нано
нити достигнут таких размеров, что создадут внутреннее давление в нано порах
гранул катализатора. Это внутреннее давление разрывает гранулы катализатора в
порошок. (Аналогичное явления происходит, когда грибы разрывают асфальтовое
покрытие почвы.) Для того, чтобы остановить неограниченный (непропорциональный)
рост нано нитей нужно увеличить количество молекул Н2О в 4 раза (т.е. нарушить
стехиометрию) соответственно увеличивается количество молекул Н2О с энергией
более 1,22 эВ и как следствие гранулы катализатора не разрушаются [1,2].
Рассмотрим макро механизм переноса тепла
от внутренней стенки тепла обогреваемой трубы к слою гранул катализатора. Смесь
метана и водяного пара подаётся в обогреваемую трубу и эта смесь газов подаётся
при температуре 700 – 800К. Если мы рассмотрим химическую термодинамическую
вероятность отложения углерода в зависимости мольного отношения Н2О/СН4 от
температуры нагрева этой газовой смеси, то будет видно, что свободный углерод
должен образовываться до температуры более 1100К, если 2 < Н2О/СН4 < 3. При температуре реагирующей
смеси Н2О и СН4 более 1100К углерод не должен отлагаться согласно химической
термодинамической вероятности. Однако условия переноса тепла в слое гранул
катализатора не позволяет осуществить постоянство температуры по радиусу обогреваемой
трубы. Это соответствует физическому смыслу переноса тепла от нагретой стенки к
холодному газовому потоку. Необходимо увеличивать отношение Н2О/СН4 , как это и
делается в промышленном агрегате, т.е. всегда
Н2О/СН4 > 3. Для этого
следует следующее объяснение. Если в
обогреваемой трубе с катализатором реализуется стехиометрическая реакция (1) у
которой тепловой эффект 204 кДж/моль. В этом случае происходит реакция (1), а
реакция (2) полностью не проходит, на неё тепла не хватает и происходит не пропорциональный
рост нано углеродных нитей, которые разрывают гранулы катализатора в порошок, и
наступает аварийная ситуация. Когда увеличивают отношение Н2О/СН4 , то фактический эндотермический
тепловой эффект уменьшается согласно выведенной из расходных и
термодинамических параметров формулы {1}:
![]()
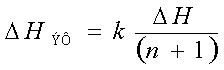
∆НЭФ = k
∆Н /(n – 1) , где ∆НЭФ
– эффективный тепловой эффект ; ∆Н – стандартный тепловой эффект; n – коэффициент превышения количества Н2О в отношении
Н2О/СН4= n, k – Коэффициент учитывающий содержание других газов,
кроме Н2О, СО2 и СН4, k = 1 если в
реагирующем газе содержаться только названные газы. Например: n = 2, то ∆НЭФ = 70 кДж/моль ; n = 3, то
∆НЭФ = 50 кДж/моль ; n = 3, то ∆НЭФ = 40 кДж/моль. Какой выбрать коэффициент n при
проектировании трубчатого агрегата зависит от целого ряда расходных параметров,
размеров основных конструкционных элементов, активности катализатора, давления
реагирующего газа в трубах и других особенностей. Названы только базовые и
основные условия.
Самое большое количество природного газа в
химической промышленности используется при производстве аммиака. Из аммиака в
основном получают азотную кислоту и азотные удобрения. Современные комплексы
агрегатов ориентированы на производство до 1500 тонн аммиака в сутки. Природный
газ, поступающий из магистрали, в комплексы производства разделяется на два
потока. Первый поток используется собственно для получения водорода
использующегося для синтеза аммиака. Второй поток используется для
энергетического обеспечения производства в целом. Природный газ, используемый
для химических превращений, подвергается очищению от механических включений –
пыли и капельной жидкости. Далее природный газ очищается от соединений серы
(сернистые соединения в природном газе есть всегда) до 0,5 мг/м3. Сера заражает
никелевый катализатор и понижает его активность. После очистки от серы
природный газ смешивается с ранее полученным водяным паром с отношением около
Н2О/СН4= 4. Эта парогазовая смесь сначала компримируется и затем нагревается
отходящими газами, из агрегата конверсии природного газа обогревавшими трубы с
катализатором. Конвертированный газ после выхода из трубчатого агрегата
содержит остаточный метан, большое количество водяного пара, окись углерода,
двуокись углерода и водород для синтеза аммиака. Далее конвертированный газ
проходит ряд аппаратов. С начала в шахтном реакторе происходит окончательная
конверсия метана. В шахтном реакторе добавляется очищенный воздух в количестве
необходимом для обеспечения синтеза аммиака азотом воздуха. Потом в слое
специального катализатора окись углерода реагирует с водяным паром, превращаясь
в двуокись углерода и дополнительный водород. Затем из технологического газа
выделяется двуокись углерода. После этого конденсируются большое количество
водяного пара. Полученный технологический газ, содержащий в необходимых
пропорциях азот и водород, компримируется и поступает колону синтеза аммиака.
Далее технологический газ проходит систему аппаратов в которых происходит
отделение образовавшегося аммиака и возвращение в цикл синтеза аммиака не
прореагировавшего технологического газа. В конце общего технологического цикла
получают жидкий и газообразный аммиак.
Конверсия природного газа в трубчатых
агрегатах на катализаторе является практически единственным методом получения
синтез газа для синтеза метанола СН3ОН. Химическая формула образования метанола
следующая: СО + 2 Н2 = СН3ОН (4). Для получения необходимого стехиометрического
состава синтез газа в агрегате конверсии должна быть следующая стехиометрия по
химической формуле: 3СН4 + 2 Н2О + СО2 = 4СО + 8 Н2 (5). Видно, что
на вход в обогреваемую трубу подаётся ещё и двуокись углерода СО2.
Однако, как показано выше, это химическое превращение не может быть
осуществлено, т.к. в условиях стехиометрии будет выделяться свободный углерод в
порах гранул катализатора, и соответственно гранулы будут разрушаться в
порошок, создавая аварийную ситуацию в трубчатом агрегате конверсии природного
газа. Поэтому в реакцию (5) добавляется
дополнительное количество водяного пара (формула {1}) и формула химической
реакции будет следующей: 3СН4 + 4Н2О + СО2 = 4СО + 8 Н2 + 2 Н2О (6). Механизм
предотвращения выделения свободного углерода по формуле (6) объясняется выше.
Газ из агрегата конверсии в систему аппаратов отделения и конденсацию воды.
(Это не производительная операция)
Полученный синтез газ (СО + 2 Н2)
направляется в реактор синтеза метанола.
Каталитическая конверсия углеводородов
попутных газов в обогреваемых трубах
используется для гидрирования тяжелых
фракций нефти [3]. Для этого используется конвертированный газ после удаления и
конденсации водяного пара. Обработка тяжелых
фракций водородосодержащим технологическим газом (содержание Н2 до 75%)
из трубчатого агрегата проводится в системе аппаратов заполненных
катализатором. Существует значительное количество технологических схем для
гидрогенизации тяжелой нефти.
Каталитическая конверсия в обогреваемых
трубах незаменима при прямом восстановлении железа. В этом случае получают
восстановительный газ. Это водород и окись углерода, содержание других газов не
должно превышать 10%. Прямое восстановление
железа из руды это получение чистого сырья без углерода, серы, фосфора и азота. Эти вещества попадают в
железо из чугуна, который в свою очередь получает эти загрязнения из кокса.
Рафинирование железа полученного из чугуна сильно затратный процесс. Рафинированное железо необходимо для варки
прецизионных легированных сплавов современной техники. Сырье для прямого восстановление железа, не
требующего специального рафинирования, получают из специально очищенной
железной руды. Из концентрата содержащего только окислы железа делают
специальные гранулы (окатыши), которые
подаются специальный шахтный реактор. Для восстановления окислов железа самый
дешевый способ это использования восстановительного газа. Суммарные химические
формулы этой технологии следующие: Fe2O3 + 3 H2 = 2 Fe + 3 H2O (7) и Fe2O3 + 3 СО = 2 Fe + 3СО2
(8). В этом случае может быть использован только чистый восстановительный газ
(СО и Н2), т.к. даже малое количество Н2О и СО2 резко снижает
производительность шахтного реактора. В
этом случае необходим химический процесс аналогичный химической формуле (5), но
как выяснено выше процесс пойдет с выделением свободного углерода и
соответственно с разрушением катализатора.
Однако в реформере проводится реакция с отношением (Н2О+СО2)/СН4=1,2 без
выделения свободного углерода. Достигается это по макро физическому смыслу
формулы {1} ∆НЭФ = k ∆Н /(n – 1). В реформер поступает на конверсию
конвертируемая смесь газов следующего состава: СН4 – 15%; Н2О – 8%; СО2 – 10%;
СО – 37% и Н2 – 30%. Таким образом n = 8,5 ,
а k = 1,5 и получаем ∆НЭФ = 41
кДж/моль. На выходе из реформера состав
конвертированного газа: СН4 = 3%; (СО2
+ Н2О) = 3%; (СО + Н2) = 94%. Реформированный газ идет в шахтную печь, где
происходит восстановление железа.
Колошниковый газ из шахтной печи подвергается обработке для восстановления
исходного состава смеси газов идущих в реформер на рециркуляционную конверсию. Таким образом, происходит
рециркуляция восстановительного газа. В таких условиях отложения свободного
углерода снижается, но полностью не
исключено. Поэтому, через 20-40 суток реформер останавливается на холостой ход.
Во время холостого хода катализатор, которым заполнены обогреваемые трубы,
обрабатывается специальной смесью газов, которая удаляет накопившейся свободный
углерод. Холостой ход после 5-7
каратного осуществления в значительной степени снижает активность катализатора, поэтому катализатор служит не
более года. Это объясняется тем, что вовремя холостого хода удаляется не только
свободный углерод, но и нано углеродные нити (размеры которых не деформируют
стенки нано пор). Исчезновение в катализаторе нано углеродных нитей под
воздействием газов осуществляющих холостой ход приводит к сокращению и
уменьшению активных центров реакции, т.е. снижается активность катализатора.
Более того обломки отломленных верхних частей нано дендритов (никелевых
активных центров) препятствует проникновению реагирующих газов в глубину гранул
катализатора и препятствуют образовавшимся газам мигрировать во внешний газовый
поток. Таким образом, каждое включение холостого хода поэтапно снижает
активность катализатора, превращая его в инертный материал. Это хорошо видно по
снижению производительности шахтного реактора. При достижении контрольного
граничного расхода восстановленных окатышей железа, реформер останавливают и
производят замену катализатора в части труб или всех.
При доменной выплавке чугуна на всех
домнах используется метановое дутье. Это делается с целью первичного
энергосбережения, экономии кокса и снижения загрязнения окружающей среды.
Замена метанового дутья, конвертированным газом, полностью сохраняются
технологические преимущества использования природного газа в доменном процессе,
и добавляет вторичное энергосбережение. Это снижение потребление энергии
складывается из двух аспектов. Первый аспект это снижение энергетических затрат
в слое руды превращающейся в жидкий чугун. Метан (природный газ) разлагается в
слое разогретой коксом руды по химической формуле СН4 → 2 Н2 + С (9).
Водород интенсифицирует процесс образования чугуна на 40%. Однако для осуществления реакции (9)
требуется затратить тепла 12750 кДж/кг. Эта необходимость снижает
экономию кокса. Поэтому водород и окись углерода можно получить в реформере в
непосредственной близости от доменной печи. Для обогрева труб с катализатором
размещенных в реформере используются колошниковые газы, обогащенные природным
газом.
Наиболее технологичные способы и методы получения редких
металлов (никель, кобальт, вольфрам, молибден) это получение из рудных
концентратов специальными технологиями окислов этих металлов. Обработка этих
окислов до металлического состояния согласно теории химической термодинамики
имеет условия наименьших затрат энергии, если эти окислы обрабатывать
восстановительными газами состоящими из водорода и окиси углерода. Наиболее
эффективный способ получения этих газов это стехиометрическая каталитическая
конверсия природного газа продукцией, которой является смесь водорода и окиси
углерода.
Литература:
1. Igumnov V.S. “Technical and technological methods of
realization of steam catalytic conversion of natural gas with a methane-water
proportion close to stoichiomythic ratio” , Hydrogen materials science and
chemistry of carbon nanomaterial, NATO security science setias – A: Chemistry
and Biology.
2. Игумнов В.С.,
«Каталитическая конверсия углеводородов в обогреваемой трубе при отношении
пар/газ близком к стехиометрическому» /"Катализ в промышленности",
№6, 2010, с34-40.
3. Игумнов В.С. , Тепляков И.О.,
«Конверсия углеводородов для утилизации попутных газов на удалённых нефтяных
промыслах в экологически чистые дизельное топливо и бензин», «Экология и промышленность России» (ЭКиП). №3, 2012.