Химия и
химические технологии/7. Неорганическая химия
Аспирант Белов П.П., д.х.н., член-корр. РАН, профессор Стороженко П.А., Волошина Н.С., к.х.н.
Печурина С.Я.
Государственный научно исследовательский институт
химии и технологии элементоорганических соединений, Россия
НЕПИРОЛИТИЧЕСКИЙ СПОСОБ ПОЛУЧЕНИЯ
ДЕКАБОРАНА
Декаборан относится к числу наиболее
перспективных бороводородов и является основным исходным компонентом для
получения самой широкой гаммы замещенных и незамещенных карборанов.
Основным и наиболее изученным способом
получения декаборана является пиролиз диборана. Описаны способы получения
декаборана в циркуляционных системах при атмосферном давлении при температуре 230-240ºС или при повышенном давлении (20-40 атм.) при
более низкой температуре 90-100°С и быстрым охлаждением продуктов реакции, конденсацией образующегося
декаборана и возвратом не прореагировавшего диборана. Многократной циркуляцией
достигается практически полная конверсия, выход декаборана составляет 80% с содержанием основного
продукта 95-98%. Использование алифатических углеводородов повышает конверсию
диборана[1].
Одним из альтернативных способов получения
декаборана является взаимодействие
боргидрида натрия с галоидными алкилами и кислотами Льюиса с образованием
промежуточного продукта – ундекабората натрия и последующим его окислением [2].
Сравнивая эти способы получения декаборана по пожаро-,
взрывоопасности, технологическому оформлению, способам очистки и экологической
безопасности, необходимо отдать предпочтение второму наиболее безопасному
методу с использованием в качестве исходного продукта натрийборгидрида.
Исследование направлено на разработку
способа получения декаборана, исключающего применение диборана. Этот способ
основан на взаимодействии боргидрида натрия с бромистым пентаном в среде диглима с
последующим окислением ундекабората натрия до целевого продукта.
Нами проведено постадийное исследование процесса
получения декаборана из боргидрида натрия. Всего процесс состоит из трех
стадий:
1.
синтез ундекаборат иона B11H14¯ из NaBH4 и C5H11Br в диглиме при
температуре 90-110ºС;
2.
замена донорного
растворителя водой;
3.
окисление водного раствора NaB11H14 с получением
декаборана.
90-110°С
На первой стадии реакция боргидрида натрия c 1-бромпентаном в диглиме при температуре 105-110°С
протекает с образованием NaB11H14 по схеме:
![]() 11NaBH4 + 10C5H11Br
NaB11H14 +
10C5H12
+ 10NaBr + 10
H2 (1)
11NaBH4 + 10C5H11Br
NaB11H14 +
10C5H12
+ 10NaBr + 10
H2 (1)
В ходе её изучения
установлено, что на этой стадии процесса принципиально важным и значимым
является интенсивность перемешивания реакционной смеси. Диборан, образующийся в
качестве промежуточного продукта, при недостаточном перемешивании проскакивает через реакционную массу и
выносится выделяющимся в результате реакции водородом. Поэтому для более
полного превращения диборана в
ундекаборат натрия нами использовалась высокооборотная турбинная мешалка.
Анализ полноты прохождения процесса осуществляется путём поглощения, не вступившего
в реакцию диборана триэтиламином с образованием комплекса триэтиламинборана:
2 (C2H5)3N
+ B2H6
→ 2 (C2H5)3N∙BH3
(2)
Одним из определяющих
факторов ведения процесса является скорость перемешивания. Увеличение числа
оборотов мешалки с 300 об/мин до 1000 об/мин позволило снизить проскок диборана
на 15-20%.
Установлено, что для
полноты конверсии исходного натрийборгидрида необходимое время взаимодействия должно быть не менее 7 часов. Эти условия
могут быть обеспечены использованием перистальтического насоса, который
позволяет осуществить подачу с
заданной и постоянной скоростью на уровне 0,5 мл/мин.
При изучении температурного
режима ведения реакции найдено, что даже незначительное изменение температуры
существенно влияет на ход реакции. Как показали проведенные нами дополнительные
исследования на этой стадии процесса в реакционной массе присутствует ион B9H14¯,
образование которого увеличивается при понижении температуры реакции до 95°С и
может достигать 7%. Повышение температуры до 105°С существенно снижает
концентрацию этого иона в реакционной массе. Повышение температуры более 110°С
приводит к снижению выхода целевого продукта. Зависимость выхода ундекабората
натрия от температуры приведена на рис.1. Реакционная смесь выдерживается при
этой температуре еще в течение 1 часа до прекращения газовыделения, раствор
ундекабората натрия фильтруется и
фильтрат подаётся на вторую стадию для замены диглима на воду.
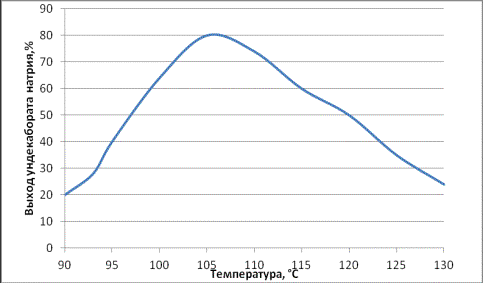
Рис.1. Зависимость выхода
ундекабората натрия от температуры.
Для получения водного раствора
ундекабората натрия реакционная масса заливается 3 раза гексаном, каждый раз
перемешивая и удаляя верхний слой диглима и гексана, до тех пор, пока не
удалится весь диглим и не останется твёрдый продукт желтого цвета – диглимат
ундекабората натрия, который растворяется в воде.
Полученный водный раствор
подвергается окислению на третьей стадии процесса, а экстракция образующегося
декаборана осуществляется толуолом.
В качестве окислителя
выбрана двуокись марганца, которая является мягким окислителем,
не затрагивающим толуол, используемый
в качестве растворителя образующегося декаборана. Реакция окисления
проходит в мягких условиях почти при комнатной температуре (29-32°С).
2NaB11H14 +2H2SO4 + MnO2 + 4Н2О →2B10H14 + 2B(OH)3 + MnSO4 +Na2SO4+3Н2 (3)
Окисление ундекабората натрия
проводится в растворе разбавленной серной кислоты свежеприготовленной двуокисью марганца, которая получается
обработкой кислого водного слоя перманганатом калия в сернокислой среде.
В связи с тем, что в толуольном растворе декаборана присутствует
вода, которая его разлагает, необходимо осушение толуольного раствора.
Освободиться от следов воды позволяет бумажный фильтр марки 1PS фирмы Whatman. Из
толуольного раствора отгоняется растворитель, а выпавший декаборан очищается
сублимированием.
В литературе описывается
реакция окисления, в результате которой из двух молекул ундекабората натрия
образуется одна молекула декаборана:
2NaB11H14 +27H2SO4 + 26MnO2→B10H14 + 12B(OH)3 + 26MnSO4 +Na2SO4+16Н2О (4)
В результате проведенных
исследований определены такие условия
ведения процесса, что каждая молекула ундекабората натрия превращается в молекулу декаборана (3).
Экспериментальная разработка позволила предложить непиролитический
метод получения декаборана, исключающий использование пожаро-взрывоопасного и
токсичного газообразного диборана, определить оптимальные технологические
параметры процесса: температуру, время и скорость перемешивания, что позволило повысить
выход целевого продукта на 15%.
Литература:
1.
Polak R.J., Obenland
C.O., Pyrolysis of diborane. Formation of decaborane in continuous flow
reactor. Ind. Eng. Chem., Prod. Res. Develop., 1964, v.3, p.282
2.
Dunks G.B., Barker K.,
Hedaya E., Hefner C., Palmer- Ordonez K., Remec P., Simplified synthesis of
B10H14 from NaBH4 via B11H14¯ ion, Inorg. Chem., 1981, v.20, p.1692-1697.