Д.х.н. 1Цыганкова
Л.Е., д.х.н. 2Вигдорович В.И., асп. 2Морщинина И.В., д.х.н. 2Шель Н.В., к.х.н. 1Урядников А.А., к.х.н. 1Есина М.Н.
1 Тамбовский государственный университет имени Г.Р.
Державина,
Тамбов, Россия. E-mail: vits21@mail.ru.
2 Всероссийский научно-исследовательский институт
использования техники и нефтепродуктов. Тамбов. Россия.
Сорбция кальция глауконитом
Вопросы снижения жесткости питьевых и
технологических вод были и остаются весьма актуальными. Для их решения
существуют многочисленные методы, включая сорбционное умягчение. В связи с этим
представляет интерес использование в качестве сорбентов природных продуктов.
Одни из них – природные глинистые минералы перспективны как технологические
сорбенты (монтмориллонит, вермикулит, каолинит, глауконит), другие – как
биоиндикаторы (мхи, грибы, земли, богатые органическими веществами).
Природные глинистые сорбенты в исходном
состоянии [1-4], либо как модифицированные продукты [5, 6] широко исследуются применительно
к сорбционной очистке водных сред от катионов металлов. Их сравнительно малая
адсорбционная емкость легко компенсируется большими запасами месторождений,
простотой и технологичностью получения и применения, экологической чистотой и
малой себестоимостью.
Целью настоящего сообщения явились результаты
экспериментальных исследований сорбции катионов Ca2+ из хлоридных растворов,
не содержащих и содержащих Na2SO4 и KNO3.
Сорбция проводилась из растворов СаСl2 с исходной
концентрацией 2,5 мМ либо при их разведении в 2, 4, 6, 8 раз, содержащих в
специальных сериях 16,5 мМ либо 1,65 мМ Na2SO4 или 5 мМ и 0,5 мМ KNO3, что имитировало
природные воды.
В качестве сорбента использован 95 %-й
концентрат глауконита Бондарского месторождения (Россия), которое включает до 420
млн. т минерала с содержанием активного начала до 40 масс. %.
Величина водородного показателя модельных
растворов равна 5,8 – 5,9. С целью подготовки сорбент предварительно отмывали
от Са2+ и Mg2+ 3 М раствором NaCl
с переводом в Na-форму. В каждом отдельном опыте использовали 100 мл
раствора, перемешиваемого магнитной мешалкой, в который предварительно вводили
1, 2, 3 или 5 г сорбента.
Концентрацию катионов Са2+
фиксировали комплексометрическим титрованием трилоном Б с индикатором эриохром
черный Т по методике, рекомендованной [7]. Глубину извлечения Са2+
оценивали посредством коэффициента ρ, представляющего собой отношение
разности исходной массы катионов и по завершению эксперимента к ее начальной
величине. Все данные получены при комнатной температуре.
Экспериментальные
результаты. На
рис. 1 в качестве примера представлены результаты сорбции Са2+ из
2,5 мМ хлоридного раствора, не содержащего посторонних солей.
|
|
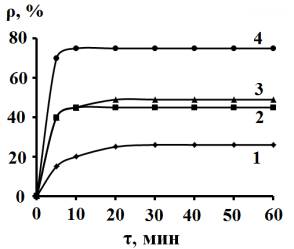
Рис.1.Зависимость коэффициента извлечения Са2+
из 2,5 мМ растворов СаСl2 от продолжительности
сорбции и массы сорбента (mсорб, г/100 мл). mсорб: 1 – 1, 2 – 2, 3 – 3,
4 – 5. |
Введение в исходный раствор 1 г сорбента за
первые 5 минут снижает начальное содержание Са2+ на 15 %,
последующая сорбция в течение 15 минут ведет к возрастанию ρ до 20 %. Дальнейшее
проведение эксперимента не изменяет ρравн. Емкость сорбента
(рис. 1) невелика. Это подтверждается и последующим повышением вводимой ее
массы. Так, ее 5-ти кратное увеличение повышает ρравн до 74 %.
Таким образом, наблюдается неравенство m5/m1 > ρ5/ρ1,
где нижний индекс характеризует массу сорбента в г, что объясняется некоторым
слипанием частиц твердой фазы суспензии.
Введение в исходный раствор 16,5 мМ Na2SO4 ведет к существенному
понижению ρравн (рис. 2).
|
|
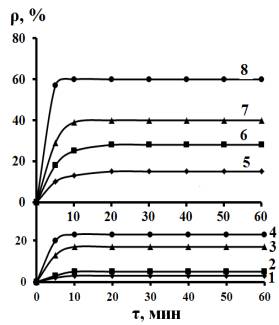
Рис.2. Зависимость коэффициента ρ извлечения
Са2+ из 2,5 мМ растворов СаСl2, содержащих 16,5 (1 -
4) и 1,65 (5 - 8) мМ Na2SO4, от продолжительности
сорбции и массы сорбента, г/100 мл: 1 и 5 – 1; 2 и 6 – 2; 3 и 7 – 3; 4 и 8 –
5. |
Снижение содержания сульфата натрия в 10 раз
существенно повышает ρравн (рис. 2), который, однако, остается
ниже, чем в отсутствие сульфат-ионов. Подобная картина наблюдается и в
присутствии 5 мМ и 0,5 мМ KNO3. Оценка изотерм сорбции
(Фрейндлиха, Темкина, Ленгмюра) в координатах их линеаризации показала, что с
наибольшей вероятностью (с учетом и литературных данных) адсорбция Са2+
глауконитом описывается изотермой Ленгмюра. Параметры сорбции: максимальная
удельная адсорбция (К2), константы сорбционного равновесия (К1)
и скорости адсорбции Кс, а также ΔGадс обобщены в таблице.
Таблица. Величины констант адсорбции Са2+
концентратом глауконита.
|
Среда СаСl2 с добавкой соли |
К1, л/моль |
Г∞, моль/г |
ΔGадс,кДж/моль |
Кс,мин-1 |
|
Добавка отсутствует |
3120 |
0,120 |
19,5 |
0,165 |
|
16,5 мМ Na2SO4 |
3800 |
0,016 |
20,0 |
0,070 |
|
1,65 мМ Na2SO4 |
1280 |
0,050 |
17,4 |
0,026 |
|
5 мМ KNO3 |
1110 |
0,018 |
17,1 |
0,087 |
|
0,5 мМ KNO3 |
1930 |
0,040 |
18,4 |
0,058 |
Выводы:
1. Предельная удельная адсорбция глауконитом
катионов Са2+ невелика, находится на уровне сорбции других катионов:
Mg2+, Sr2+, Fe2+, Mn2+ и снижается в
присутствии посторонних солей. Однако этот недостаток компенсируется малой
стоимостью сорбента и его экологической чистотой.
2. При однократной сорбции из перемешиваемых
растворов удается достичь величины ρравн Са2+, порядка
80 % при τравн= 20 мин.
Литература.
1.Чиркст Д.Э., Литвинова Т.Е., Черемисина О.В.,
Иванов М.В, Мироненкова Н.А. // Журн. прикл. химии. 76 (2003). 755-758.
2. Голдовская–Перистая А.Ф., Воловичева Н.А.,
Везенцев А.И., Перистый В.А. // Сорбционные и хроматографические процессы. 11
(2011). 165 – 171.
3. Srivastаva P., Singh B., Angove M. // J. Colloid Interface Science. 290 (2005). 26 – 38.
4. Вигдорович В.И., Цыганкова Л.Е., Богданова
Е.П., Николенко Д.В., Акулов А.И. // Сорбционные и хроматографические процессы.
14 (2012). 20 - 24.
5. Zhao Jing, Zhu
Y.-J,Wu J., Zheng J-Q, Zhao X.-Y., Lu B-Q., Chen F. //
J. Colloid Interface Science. 418
(2014). 208 – 215.
6. Rozic M.,
Cerjan-Stefanovic S., Kurajica S., Maeefaz M.R., Margeta K., Farkas A. // J. Colloid
Interface Science. 284 (2005). 48 - 56.
7. Шварценбах Г., Флашка Г. Комплексометрическое
титрование. М.: Химия. 1970. 360 с.
Исследование проведено в рамках выполнения
задания Министерства образования и науки РФ № 2014/285 (проект № 1501) на
оборудовании ЦКП «Нанохимия и экология» Тамбовского государственного
университета имени Г.Р. Державина.