А.А. Басов 1,
М.Г. Барышев 2, С.С. Джимак 2, Е.В. Масычева2,
Д.И. Шашков2
1ГБОУ ВПО «Кубанский государственный медицинский университет» Минздравсоцразвития
России, г.Краснодар.
2ФГБОУ ВПО Кубанский государственный университет, Россия, г.Краснодар.
e-mail: jimack@mail.ru
Влияние воды с модифицированным изотопным составом на показатели
Свободнорадикального окисления ТКАНЕЙ И КРОВИ ЛАБОРАТОРНЫХ ЖИВОТНЫХ
Одним
из перспективных пищевых веществ для коррекции антиоксидантного потенциала
организма является вода с
модифицированным изотопным составом (ВМИС), например, вода с пониженным
содержанием дейтерия [1]. Известно,
что человек в физиологических условиях потребляет до 2-3 литров жидкости в
сутки, поэтому изменение структуры питания за счет ВМИС с пониженным
содержанием дейтерия может оказывать влияние на показатели АОС. Во всем мире в
последние годы достаточно активно изучаются различные эффекты ВМИС с пониженным
содержанием дейтерия – основное ее действие на организм заключается в
постепенном снижении содержания дейтерия в биологических жидкостях и тканях за
счёт реакций изотопного обмена. В научной литературе чаще описаны биологические
эффекты ВМИС, тогда как молекулярные механизмы ее действия на организм еще полностью
не исследованы. ВМИС с пониженным содержанием дейтерия оказывает влияние на рост
опухолевых клеток различных культур [2-4], обладает иммуномодулирующим свойством
[5, 6], влияет на обмен пероксида водорода в печени. Цель исследования: оценить влияние изотопного
обмена на показатели свободнорадикального окисления тканей и состояние
антиоксидантной системы крови у лабораторных животных при использовании в
пищевом рационе воды с модифицированным изотопным составом с пониженным
содержанием дейтерия в физиологических условиях и при воспалительных процессах.
Материалы
и методы
Объектом исследования была кровь и гомогенаты
органов (печень, почки) крыс-самцов весом 90-100 грамм. Крысы были разделены на
следующие группы: группа №1 (получающие дистиллированную минерализованную воду
(158 ppm) в течение 30 дней, n=40), группа №2 (получающие
дистиллированную минерализованную воду (158 ppm) в течение 30 дней, имеющие
гнойное воспаление мягких тканей, n=40), группа №3 (получающие дистиллированную
минерализованную воду с пониженным содержанием дейтерия (40 ppm)
в течение 30 дней, имеющие гнойное воспаление мягких тканей, n=40).
Воду с пониженным содержанием дейтерия получали
на установке, разработанной в Кубанском государственном университете. Исходная
концентрация дейтерия в получаемой воде составляла 40 ppm.
При моделировании гнойной раны у крыс, использовали двухэтапную модель окислительного
стресса. Первый этап представлял собой
острую фазу окислительного стресса и моделировался путем создания межмышечного
абсцесса в мягких тканях длинных мышц спины лабораторного животного с
использованием имплантированного инородного тела. Второй этап отражал
хроническую фазу окислительного стресса и моделировался гнойной раной, которая
формировалась естественным образом при дренировании абсцесса и удалении
инородного тела.
Определение концентрации дейтерия в плазме были
проведены с помощью ядерного магнитного резонанса (ЯМР) на импульсном
ЯМР-спектрометре JEOL JNM-ECA 400MHz.
Измерение спектров электронного парамагнитного
резонанса (ЭПР) проводили при комнатной температуре на спектрометре JES Fa 300
(JEOL, Япония) в X-диапазоне.
Спектры ЭПР образцов печени лабораторных мышей
содержат анизотропный синглетный сигнал (рис. 1), параметры спин-гамильтониана
(g^ = 2.0074, g÷ï = 2.003) которого соответствуют
стабильным радикалам. Спектры ЭПР образцов почек имеют аналогичный характер.
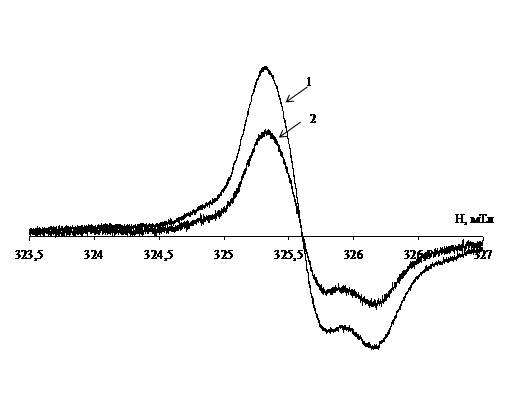
Рис. 1. Спектры ЭПР
лиофилизированных тканей печени лабораторных мышей группы 2 (линия 1) и группы 3
(линия 2).
Дополнительно для оценки
состояния эндогенной антиоксидантной системы проводили определение антиокислительной
активности (АОА) плазмы крови амперометрическим способом на анализаторе
антиоксидантной активности “Яуза-01-ААА”.
Статистическую обработку
полученных данных осуществляли методами вариационной статистики с
использованием t-критерия Стьюдента. Достоверным считали различие при
р<0,05.
Результаты
и обсуждение
В
результате проведенного исследования установлено, что наиболее низкое содержание
дейтерия в биологических жидкостях и тканях зафиксировано у животных группы 3,
которые получали в пищевом рационе ВМИС с пониженным содержанием дейтерия, оно было
меньше на 37,3% и 38,9% в сравнении с показателями в группе 1 и 2
соответственно, что свидетельствует о достоверном (p<0,05) изменении
через 30 дней после начала исследования содержания дейтерия в крови (табл. 1).
Таблица 1.
Показатели содержания дейтерия, интенсивности
свободнорадикального окисления, состояния антиоксидантной системы в крови и
тканях у крыс при использовании в пищевом рационе воды с модифицированным
изотопным составом.
|
Показатель \
группа |
Содержание дейтерия
плазмы, ppm |
АОА плазмы, нА·с |
МВХЛ плазмы, усл. ед. |
ЭПР печени, ПМЦ/г |
ЭПР почки, ПМЦ/г |
|
Группа 1 (n=40) |
153,3±0,4 |
1246,4±23,7 |
1,993±0,024 |
960,23±56,22 |
608,61±44,01 |
|
Группа 2 (n=40) |
157,5±0,4 |
948,2±21,8 * |
3,058 ± 0,081 * |
1584,25±112,99 * |
747,87±55,13 * |
|
Группа 3 (n=40) |
96,1±0,5 *,** |
1137,1±24,2
*, ** |
2,716±0,126 *,** |
1316,80±66,69 *,** |
720,66±57,07 * |
|
* - p<0,05 в сравнении с показателями
группы № 1 ** - p<0,05 в сравнении с показателями
группы № 2 |
|||||
При
этом следует отметить, что показатели дейтерия в плазме прекращали снижаться
после достижения значений в 90-100 ppm и дальнейшего его
уменьшения не происходило, несмотря на более низкие показатели содержания
дейтерия в потребляемой лабораторными животными ВМИС (40 ppm),
что позволяет предположить наличие в организме механизмов, способных
регулировать в определенном физиологическом интервале изотопный состав
биологических жидкостей, предупреждая резкие перепады количественного
содержания изотопов водорода в разных тканях и органах. При
сравнении интенсивности образования свободных радикалов в лиофилизированных
органах было установлено, что печени и почках у крыс с моделированным
окислительных стрессом (группы 2 и 3) наблюдалось достоверное повышение
концентрации ПМЦ (табл. 1), что свидетельствует об устойчивом превалировании на
клеточном уровне прооксидантных факторов над компонентами АОС, при этом более
существенные изменения наблюдались в гомогенатах печени у животных в группе 2,
в которых концентрация ПМЦ превышала значения контрольной группы 1 на 64,9% (p<0,05), что говорит об активном участии
печени в обезвреживании токсических субстанций, образующихся при
гнойно-воспалительных процессах, следствием чего становится повышение
образования в гепатоцитах активных форм кислорода и формирования ОС на тканевом
и органном уровнях. Следует отметить, что содержание ПМЦ в гомогенатах печени у
животных 3 группы также существенно превышало аналогичные показатели в группе 1
на 37,1% (р<0,05), но было достоверно ниже показателей группы 2 на 16,9% (p<0,05), что показывает менее выраженную
интенсивность СРО в их гепатоцитах и, видимо, указывает на более активную
работу тканевых компонентов эндогенной АОС или меньшую токсическую нагрузку на
клетки печени из очага воспаления, что, возможно, обусловлено также активацией
других неспецифических защитных систем организма ВМИС с пониженным содержанием
дейтерия, например ее иммуномодулирующим эффектом, ускоряющим локализацию
возбудителя с помощью механизмов клеточного иммунитета.
При
изучении состояния процессов СРО в гомогенатах почек были получены менее
выраженные изменения у крыс с моделированным ОС, хотя они и достоверно были
повышены в группе 2 (на 22,9%, p<0,05) и в группе 3
(на 18,4%, p<0,05) в сравнении с показателями контрольной группы 1.
При этом достоверных отличий в обеих опытных группах 2 и 3 зафиксировано не
было, что может быть связано с меньшим специфическим влиянием ВМИС с пониженным
содержанием дейтерия на эндогенную АОС почек, или меньшей способностью низко- и
среднемолекулярных гидрофильных токсических субстанций активировать
свободнорадикальные процессы в ткани почек, известно, что некоторые из них
(например мочевина, олигопептиды, мочевая кислота) могут проявлять и антиоксидантный
эффект, участвуя в перехвате свободных радикалов, что снижает содержание
свободных радикалов в органах выделительной системы.
Изменения в крови носили
более значимый характер, что связано с интегрирующей функцией крови как
биологической жидкости, отражающий весь спектр изменений, происходящих в
организме. При исследовании плазмы крови отмечено значительное снижение ее АОА
у крыс в группе 2 (на 23,9%, p<0,05),
в то время как в группе 3 было отмечено гораздо меньшее снижение АОА и ее показатели достоверно
превышали аналогичные значения в группе 3 (на 19,9%,p<0,05). Подобные изменения характеризуют
снижение потенциала эндогенной АОС, прежде всего ее низкомолекулярного
звена, во всем организме, что может
приводить к развитию различных повторных патологических процессов и осложнений.
В свою очередь уровень СРО в крови крыс 2 и 3 группы был достоверно (р<0,05)
повышен в сравнении с контролем на 53,7% и 36,7% соответственно, что указывает
на выраженную активацию прооксидантного звена, которое в свою очередь приводит
к истощению низкомолекулярных антиоксидантных факторов и развитию ОС. Менее
выраженные изменения прооксидантных показателей наблюдались у животных в группе
3, что можно объяснить меньшей токсической нагрузкой на их системы
неспецифической защиты, вследствие, более быстрого обезвреживания в печени
эндогенных токсических субстанций и иммуномодулирующего действия ВМИС с
пониженным содержанием дейтерия, уменьшающего воспалительные изменения у
животных.
Все
перечисленные выше многообразные эффекты, связанные с воздействием на организм
крыс ВМИС с пониженным содержанием дейтерия можно объяснить с помощью ряда
механизмов, реализуемых in vivo
на
молекулярном и клеточном уровнях. Так, при потреблении ВМИС с пониженным
содержанием дейтерия в клетках происходят реакции обмена Н2О на D2О
и НDO, а также быстрый H±D обмен в гидроксильных, сульфгидрильных
и аминогруппах всех органических соединений, включая белки, нуклеиновые
кислоты, липиды, сахара, что может оказывать влияние на состояние
низкомолекулярного звена АОС, одними из основных факторов которого являются
тиоловые (-SH) и гидроксильные (-ОН) группы. Кроме того, присутствие
дейтерия в биологических системах приводит к изменениям структуры и свойствам нуклеиновых
кислот и белков при образовании наиболее важных для структуры макромолекулы динамических
короткоживущих водородных (дейтериевых) связей, что может снижать активность и
ферментов антирадикальной защиты (каталазы, супероксиддисмутазы,
глутатионпероксидазы, глутатионредуктазы), уменьшая тем самым антиоксидантный
потенциал организма. В свою очередь, ВМИС с пониженным содержанием дейтерия,
снижая содержания дейтерия в тканях, восстанавливает работу ферментного звена
АОС – как за счет непосредственного взаимодействия с –OH или –SH
группами в
активных центрах, так и путем активации процессов транскрипции за счет
изменения колебательных моментов в цепях молекул нуклеиновых кислот и энергетического
облегчения их взаимодействия с ферментами, обеспечивающими считывание
генетического кода. Также при высоком содержании дейтерия происходит нарушение транспорта
ионов в клеточной мембране и увеличение сопротивления биомембраны, которое
особенно негативно сказывается на процессах ее возбудимости, поэтому
использование ВМИС с пониженным содержанием дейтерия нивелирует эти отрицательные
факторы и позволяет снизить вязкость мембран, повысить проницаемость для ионов,
улучшить передачу сигналов первичных и вторичных мессенджеров, что, в свою
очередь, восстанавливает адекватный энергообмен в тканях и снижает
прооксидантную нагрузку на клеточные структуры. В данном случае эффекты ВМИС
будут подобны другим (например, гормонам) косвенным антиоксидантам нашего
организма.
Заключение
Таким образом, следует
отметить, что в естественных условиях наблюдается отсутствие изменений
изотопного состава плазмы крови при моделировании in vivo окислительного
стресса. В тоже время при использовании ВМИС с пониженным содержанием дейтерия в
плазме крови происходит достоверное снижение концентрации дейтерия, которое
продолжается до значений в 90-100 ppm,
в дальнейшем практически не изменяющихся. При этом ВМИС с пониженным содержанием
дейтерия оказывает влияние на прооксидантно-антиоксидантную систему организма,
снижая интенсивность СРО и восстанавливая потенциал эндогенной АОС. Наибольший прямой
и косвенный антиоксидантный эффект ВМИС наблюдается в плазме крови и в
гепатоцитах, тогда как интенсивность свободнорадикальных процессов выделительной
системы изменяется менее существенно при введении ВМИС в пищевой рацион. Все это позволяет
рассматривать ВМИС как перспективное вещество для нутриционной коррекции
дисбаланса прооксидантно-антиоксидантной системы в организме.
Работа выполнена при
поддержке гранта Президента Российской Федерации для государственной
поддержки молодых российских ученых МК-1568.2014.4, государственного задания Министерства образования и науки Российской
Федерации, проект № 1269.
Список
литературы
1. Olariu L., Petcu M., Tulcan
C., Chis-Buiga I., Pup M., Florin M., Brudiu I.
Deuterium depleted water- antioxidant or prooxidant? //Lucrări Stiinłifice Medicină Veterinară.
2007. Timisoara. Vol. XL. P.265-269.
2. Bild W, Năstasă V, Haulică I. In vivo and in vitro research
on the biological effects of deuterium-depleted water: Influence of deuterium-depleted
water on cultured cell growth //Rom J Physiol. 2004. № 41(1-2). P.53-67.
3. Somlyai G. Naturally occurring deuterium
is essential for the normal growth rate of cells //FEBS Letters. 1993. Volume
317, № 1,2. P.1-4.
4. Feng-song Cong, Ya-ru Zhang, Hong-cai
Sheng, Zong-huaAo, Su-yi Zhang, Ju-yong Wang Deuterium-depleted water inhibits human
lung carcinoma cell growth by apoptosis //Experimental and therapeutic medicine.
2010. №1. P.277-283.
5. Bild W., Stefanescu I., Haulica I.
Research concerning the radioprotective and immunostimulating effects of deuterium-depleted
water //Rom J Physiol. 1999. № 36(3-4). P.205-218.
6.
Раков Д.В., Ерофеева Л.М., Григоренко Д.Е. и др.
Влияние воды с пониженным содержанием тяжелого стабильного изотопа водорода
дейтерия и кислорода 18О на развитие лучевых повреждений при гамма -
облучении в низкой дозе //Радиационная биология. Радиоэкология. 2006. Т. 46,
№4. С.475-479.