Химия и химические технологии/2. Теоретическая химия
Д.х.н., проф. Бабкин В. А., к.п.н. Диканова Е.Г,
к.т.н., доц. Шестеркин В.Д.
Волгоградский
государственный архитектурно-строительный университет Себряковский филиал,
Россия
Квантово-химический
расчет молекулы пропаналя
Целью настоящей работы являются
квантово-химический расчет молекулы пропаналя С5Н10O методом
СNDO/2 в параметризации Сантри-Попла-Сегала [1,2] с
оптимизацией геометрии по всем параметрам стандартным градиентным методом в
приближении изолированной молекулы в газовой фазе и оценка его кислотной силы.
Таблица
Длины связей и валентные
углы пропаналя
|
Длина связей |
R,Å |
Валентные углы |
Град.
|
|
O(1)-С(2) |
1.27 |
С(3) -C(2)-C(1) |
25 |
|
С(2)-С(3) |
1.46 |
С(4)-C(3)-C(2) |
5 |
|
С(3)-С(4) |
1.46 |
С(5)-C(2)-C(1) |
200 |
|
С(2)-С(5) |
1.46 |
С(6)-C(5)-C(2) |
-5 |
|
С(5)-С(6) |
1.46 |
H(7)-C(4)-C(3) |
-1 |
|
С(4)-H(7) |
1.12 |
H(8)-C(4)-C(3) |
114 |
|
C(4)-H(8) |
1.12 |
H(9)-С(4)-С(3) |
-120 |
|
С(4)-H(9) |
1.12 |
H(10)-С(3)-С(2) |
124 |
|
С(3)-H(10) |
1.12 |
H(11)-С(3)-С(2) |
-123 |
|
С(3)-H(11) |
1.12 |
H(12)-С(6)-С(5) |
1 |
|
С(6)-Н(12) |
1.12 |
H(13)-С(6)-С(5) |
120 |
|
С(6)-Н(13) |
1.12 |
H(14)-С(6)-С(5) |
-114 |
|
С(6)-Н(14) |
1.12 |
Н(15)-С(5)-С(2) |
123 |
|
С(5)-Н(15) |
1.12 |
Н(16)-С(5)-С(2) |
-124 |
|
С(5)-Н(16) |
1.12 |
|
|
|
С(5)-Н(16) |
1.12 |
|
|
Результаты расчетов
Геометрическое и электронное строение,
общая энергия пропаналя (С5Н10O)-Е0, суммарная энергия связей – Есв
показана на рис. Используя известную формулу [ 3] рКа= 43,7-190.3 * qH+max(
CNDO/2 R= 0,97 , R- коэффициент корреляции) для исследуемой молекулы С5Н10O (qH+ = +0,02, см. рис 1) определяем рКа = +39.9.
Таким образом, выполненный
квантово-химический расчет молекулы пропаналя методом CNDO/2 позволит получить оптимизированное электронное и
геометрическое строение этого соединения. Теоретическая оценка кислотной силы
пропаналя рКа = +39.9 показала, что он относится к классу очень слабых Н-кислот
(рКа> +14).
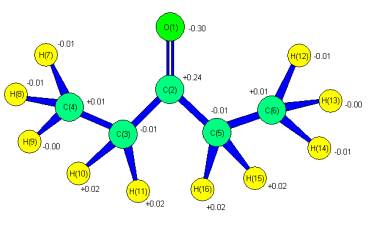
Рис.
Геометрическое и электронное строение пропаналя (EO = -34.43 A.U., ECB = -4.66 A.U., D = 0.62 dB)
Литература:
1.Сегал Дж. Полуэмпирические методы
расчета электронной структуры.-М.:Мир, 1980-327с.
2.Pople
I.A. BeveridgeD. In Approximate Molecular Orbit Theory. Mc. Grew-Hill, 1970, p.214.
3.Бабкин В.А.Строение активных центров.Механизм инициирования и роста цепи катионной полимеризации олефинов в присутствии комплексных катализаторов. Институт химической физики им. Лауреата Нобелевской премии академика Н.Н. Семенова, 1999г., 214с.