Химия и химические технологии/2. Теоретическая химия
Д.х.н.,
проф. Бабкин В.А., Кудряшов А.В.
Волгоградский
государственный архитектурно-строительный университет Себряковский филиал,
Россия
Квантово - химический расчет
молекулы диена пиперилена
Из
патентной литературы известно , что сополимеризация небольших количеств
пиперилена с изобутиленом в присутствии BF3 в
метилхлориде при -78 0 С
приводит к образованию эластомерных продуктов. Катионная полимеризация
пиперилена систематически не исследована. Подробно критический анализ
полимеризации пиперилена сделан в работе [1].Однако, геометрическое и
электронное строение этого диена до сих пор не изучено.
В
связи с этим, целью настоящей работы являются квантово-химический расчет
молекулы пиперилена методом СNDO/2 в
параметризации Сантри- Попла-Сегала[3] с оптимитизацией геометрии по всем
параметрам стандартным градиентным методом в приближении изолированной молекулы
в газовой фазе и оценка его кислотной силы.
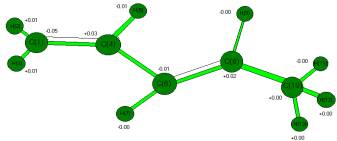
Рис. Геометрическое и электронное строение пиперилена.
(EO = -41.46A.U., ECB
= -5.53 A.U., D = 0.63 dB.)
Результаты
расчетов.
Геометрическое
и электронное строение, общая энергия пиперилена –Е0 суммарная энергия связей – Есв.
показана на рис. Используя известную формулу [ 2 ] рКа= 43.7-190.3 * qH+max ( CNDO/2 R= 0,97 , R-
коэффициент корреляции) для исследуемой молекулы пиперилена (qH+ =+0,01,
см. рис) определяем рКа =+ 41.79. Таким образом, выполненный
квантово-химический расчет молекулы пиперилена методом CNDO/2 позволит получить оптимизированное электронное и
геометрическое строение этого соединения. Теоретическая оценка кислотной силы
пиперилена рКа =+ 41.79 показала, что он относится к классу очень слабых
Н-кислот (рКа> +14).
Таблица
Длины связей и валентные
углы пиперилена
|
Длина связей |
R,А |
Валентные углы |
Град
|
|
С(1)-С(4) |
1.34 |
С(4) -C(1)-Н(3) |
122 |
|
С(1)-H(3) |
1.12 |
C(1)-C(4)-Н(5) |
120 |
|
С(1)-H(2) |
1.10 |
C(1)-C(4)-С(6) |
127 |
|
С(4)-Н(5) |
1.12 |
C(4)-C(6)-Н(7) |
119 |
|
С(4)-С(6) |
1.46 |
C(4)-C(6)-С(8) |
123 |
|
С(6)-Н(7) |
1.10 |
C(6)-C(8)-Н(9) |
120 |
|
С(6)-С(8) |
1.34 |
С(6)-С(8)-С(10) |
124 |
|
С(8)-Н(9) |
1.12 |
С(8)-С(10)-Н(11) |
112 |
|
С(8)-С(10) |
1.46 |
С(8)-С(10)-Н(12) |
112 |
|
С(10)-Н(11) |
1.12 |
С(8)-С(10)-Н(13) |
112 |
|
С(10)-Н(12) |
1.12 |
Н(5)-С(4)-С(6) |
113 |
|
С(10)-Н(13) |
1.12 |
С(8)-С(6)-Н(7) |
118 |
|
|
|
Н(9)-С(8)-С(10) |
116 |
|
|
|
Н(2)-С(1)-С(4) |
91 |
|
|
|
Н(2)-С(1)-Н(3) |
147 |
Литература:
1. Кеннеди Дж. Катионная полимеризация
олефинов.
2. Бабкин В.А. Строение активных центров, механизм
инициирования и роста цепи при катионной полимеризации олефинов в присутствии
комплексных катализаторов. Докторская диссертация. Институт химической физики
им. академика Н.Н. Семёнова, 214с.
3. Сегал Дж. Полу эмпирические методы расчета электронных структур. М. Мир, 1980, с.327.