Химия и химические технологии/2.Теоретическая химия
К.х.н. Карибьянц М.А., к.б.н. Мажитова М.В.,
Бесенова А.Б., Сергеев С.М.
Астраханский государственный университет
Исследование равновесий в водных
растворах арсеназо III в присутствии хлорида цетилпиридиния
В последнее время в литературе встречается
много работ по исследованию влияния катионных поверхностно-активных веществ
(кПАВ) на спектральные характеристики органических реагентов [1,2,3,]. Выводы о
причинах такого влияния разноречивы и носят дискуссионный характер. Основной
акцент в них делается на образование ионных ассоциатов реагентов с кПАВ. В то
же время отрицание влияния кПАВ, прежде всего, на состояние среды противоречит
всем теориям, рассматривающим ионные равновесия, в том числе и протеолитической.
Не исключая возможности образования ионных ассоциатов, мы полагаем, что
введение кПАВ оказывает влияние на среду и, в частности, на микроокружение
реагента, что в большой степени модифицирует его кислотно-основные и лигандные
свойства.
В настоящей работе представлены результаты
исследования влияния кПАВ - хлорида цетилпиридиния (ХЦП) на спектральные
характеристики одного из известных и широко применяемых реагентов азо-красителя
арсеназо III.
В работе
использовали ![]() М раствор реагента - арсеназо III, приготовленный по точной навеске препарата с учётом
содержания в нём влаги. В качестве кПАВ использовали
М раствор реагента - арсеназо III, приготовленный по точной навеске препарата с учётом
содержания в нём влаги. В качестве кПАВ использовали ![]() М растворы ХЦП, приготовленные по точной навеске препарата с
учётом содержания в нём основного вещества. Растворы нитратов металлов готовили
по точной навеске их оксидов марки «ХЧ» растворением в азотной кислоте
(1:1).Растворы разбавляли до нужной концентрации (
М растворы ХЦП, приготовленные по точной навеске препарата с
учётом содержания в нём основного вещества. Растворы нитратов металлов готовили
по точной навеске их оксидов марки «ХЧ» растворением в азотной кислоте
(1:1).Растворы разбавляли до нужной концентрации (![]() М) непосредственно перед выполнением эксперимента. Для
создания необходимой кислотности среды применяли солянокисло-ацетатные и аммиачно-ацетатные
буферные растворы, а также растворы HCl и NaOH соответствующих разбавлений. В готовых аналитических
системах pH контролировали на ионометре
И-130.
М) непосредственно перед выполнением эксперимента. Для
создания необходимой кислотности среды применяли солянокисло-ацетатные и аммиачно-ацетатные
буферные растворы, а также растворы HCl и NaOH соответствующих разбавлений. В готовых аналитических
системах pH контролировали на ионометре
И-130.
Оптические плотности растворов снимали на приборе
КФК-3 с использованием кюветы с расстоянием между светопропускающими гранями L=10,065 мм. Раствором сравнения служила
дистиллированная вода. Все измерения проводились как минимум в трёх повторах.
Растворы реагента, ПАВ, соли металлов, буферные растворы готовились на
бидистилляте.
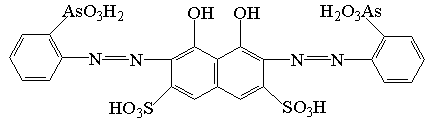
Реагенты группы арсеназо III представляют
собой восьми основную кислоту, содержащую кислотные группировки различной силы.
Согласно литературным данным [39], диссоциация реагента по сульфогруппам
происходит уже в кислых средах, по
остальным слабокислотным группировкам ионизация происходит в зависимости от их
силы в слабокислых, нейтральных и щелочных средах. Диссоциация OH- групп нафталинового кольца реагента происходит
только в сильнощелочной области.
С целью получения сравнительной картины изменения
спектральных характеристик Ars III в присутствии ХЦП предварительно были получены
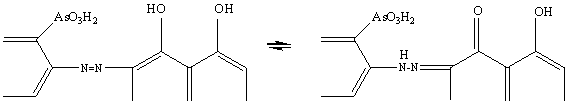
спектры светопоглощения самого красителя. В умеренно- и слабокислых средах
реагент находится в азоидной форме, а в щелочной претерпевает таутомерные
превращения в хинонгидразонную форму [40]. В этой же форме краситель находится
и в сильнощелочной среде.
Спектры светопоглощения системы R-ХЦП были получены при pH от 1 до 12 при различных соотношениях R:ХЦП. Основные спектрофотометрические характеристики Ars III и его же в присутствии ХЦП приведены
в таблице 1.
Таблица 1
Основные спектрофотометрические характеристики системы
Арсеназо III-ХЦП
|
pH |
|
|
R:ХЦП |
|
|
|
1 |
530 |
560 |
1:5 |
30 |
1,97 |
|
3 |
530 530 |
550 550 |
1:5 1:10 |
20 20 |
1,73 1,94 |
|
5 |
540 540 |
580 580 |
1:5 1:10 |
40 40 |
2,07 2,4 |
|
6 |
540 540 |
600 590 |
1:5 1:10 |
60 50 |
2,21 2,54 |
|
7 |
600 600 |
540 540 |
1:20 1:30 |
-60 -60 |
1,84 1,91 |
|
9 |
600 600 |
560 550 |
1:20 1:30 |
-40 -50 |
2,1 1,91 |
|
10 |
600 600 |
550 540 |
1:20 1:30 |
-50 -60 |
1,71 1,58 |
|
11 |
600 600 |
620 620 |
1:10 1:20 |
20 20 |
3,45 3,16 |
|
12 |
570 570 570 |
620 600 620 |
1:5 1:10 1:20 |
30 50 30 |
2,77 2,87 2,88 |
В умеренно- и слабокислых средах (pH от 1 до 6) при соотношениях R:ХЦП (1:5 и 1:10) наблюдается батохромный эффект,
степень которого закономерно возрастает с понижением кислотности среды
(∆λ=20-60 нм), что согласно [40] должно быть связано с таутомерным
превращением азоидной формы в хинонгидразонную, равновесие которого с
уменьшением кислотности среды смещается в сторону последнего. Именно такая
форма реагента обуславливает глубокую окраску. По-видимому, введение ХЦП
инициирует этот процесс превращения и облегчает его уже в кислых средах.
Очевидно, это связано с повышением активности водного протона и как следствие
облегчение протонизации одного из атомов азота азо-группы. При большом избытке
ХЦП в исследуемой системе смещение полосы поглощения относительно таковой
самого реагента не происходит. Вероятно, в этих условиях степень
структурированности водной фазы возрастает в такой степени, которая не
допускает процессы протонирования.
В нейтральных и щелочных средах до pH 10 включительно, картина цветных реакций прямо
противоположна описанной выше. Введение ХЦП в растворы арсеназо III при
соотношении 1:20 и 1:30 вызывает существенный гипсохромный эффект
(∆λ=-30-50 нм), в наибольшей степени выраженный при pH 7 и 8. Это говорит об уменьшении степени
поляризованности красителя в этих условиях, что возможно связано с блокированием
хромофорных групп, диссоциация по которым обуславливает глубокую окраску
реагента в отсутствии кПАВ.
В сильнощелочных средах (pH ≥ 11) в
присутствии ХЦП, окраска реагента в ещё большей степени углубляется (Δλ от 30 до 50 нм).
Аналогичная картина наблюдается в процессе
комплексообразования арсеназо III с ионами
некоторых многовалентных металлов [6]. Возможно, это связано с процессами,
повышающими активность водного протона в результате повышения кислотной функции
воды в щелочных средах [7] и углублением этого процесса в присутствии кПАВ.
Таким образом основную роль в изменении спектральных
характеристик реагента играет состояние водной фазы, которое изменяется под
влиянием поверхностно-активного вещества.
Литература:
1.Чернова Р.К., Кудрявцева
Л.М., Белоусова В.В. и др.
О роли поверхностно-активных веществ в изменении
спектральных характеристик органических реагентов и их хелатов с ионами
металлов // Органические реактивы в анализе. Саратов, 1979. №3(5). С. 16.
2.
Чернова Р.К., Штыков СН.,
Сухова Л.К. и др. Свойства фотометрических реагентов трифенилметанового класса, модифицированных
катионными ПАВ // Органические реактивы в анализе. Саратов, 1983. С. 3.
3.
Альбота Л.А. Влияние
солюбилизации на протолитические равновесия органических реагентов // Журнал
аналитической химии. 1986. Т. 61. № 10. С. 1780.
4. Саввин С. Б. Органические реагенты группы
арсеназо III. Атомиздат, М.:1971,
С.94-96.
5. Саввин С. Б. Органические реагенты группы
арсеназо III. Атомиздат, М.:1971,
С.175.
6. Саввин С. Б. Органические реагенты группы
арсеназо III. Атомиздат, М.:1971,
С.205-208.
7. Черкесов А.И. О
повышении протоно-донорной способности растворителя (воды) при увеличении концентрации щелочи в растворе // Материалы
21 научн. конфер. СГПИ. Саратов, 1961.
С. 148.