Федоренко К. В., Литвин В. А., Галаган Р. Л.
Черкаський
національний університет ім Б. Хмельницького, Україна
Про деякі загальні підходи до синтезу аналогів природних гумінових кислот
Природні гумінові речовини (ГР), зокрема, гумінові
кислоти (ГК) – це складний органомінеральний комплекс речовин
біогенного походження, функціональний склад і структура якого формуються за
стохастичним принципом. Відсутність генетично обумовленого плану протікання
реакцій вторинного синтезу є причиною кінетичної стійкості гумінових речовин у
біосфері [1]. Живим організмам у ході їх еволюції не вдається сформувати
ферментний апарат, специфічний до такого мінливого субстрату, і саме ця
обставина дає можливість ГР реалізувати їх планетарну функцію: створення і
підтримку резервуару вторинної органічної речовини, доступ-ної для повторного
включення у біологічні цикли.
Непостійність елементного і функціонального складу, стохастичність структурної організації гумінових кислот, як важливої складової ГР, наявність мінеральної компоненти та різних форм конституційної вологи у препаратах водночас є серйозною перешкодою для їх вивчення класичними методами хімії, які традиційно використовуються для дослідження речовин інших класів.
Ідея одержання синтетичних аналогів природних ГР
виникла ще на початку ХХ століття. Можна навести щонайменше три аргументи на
користь розвитку таких досліджень:
· хімічний синтез дозволить краще
зрозуміти природні процеси;
· існує проблема створення
стандартних зразків гумінових речовин певного складу і властивостей;
· існує проблема стандартизації
методів дослідження елементного складу природних ГР.
Метою нашого дослідження на даному
етапі є одержання полімерної органічної матриці, подібної до природних
гумінових кислот за елемент-ним
складом, молекулярно-масовим розподілом та протолітичними власти-востями. Типовий елементний склад
органічної частини гумінових кислот грунтів за даними [1] є таким: С –55,4 ± 3,8 %,
Н – 4,8 ± 1,0 %, О – 36,0 ± 7,7 %,
N – 3,6 ± 1,3
%, S – 0,8 ± 0,1 %.
В основу
формування матриці нами покладено реакцію полікон-денсації пірокатехіну з
уротропіном І. Вибір конденсуючого агента обумов-лений тим, що за умов
існування у кислому середовищі рвноваги:
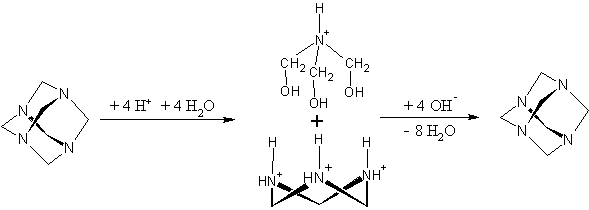
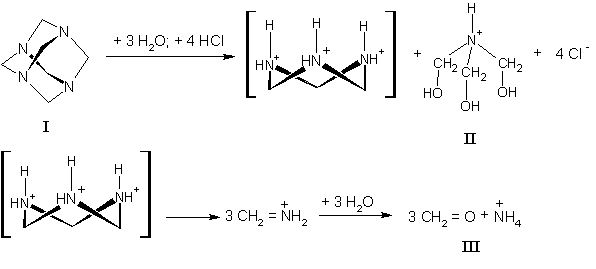
уротропін може давати принаймні два проміжних
продукти, здатних до конденсації з фенольною компонентою: це власне формальдегід ІІІ та
три-оксиметиленамініум катіон ІІ.
Останній є тим нітрогенвмісним компонентом, який може
включатися в основний ланцюг з утворенням продуктів конденсації типу ІV та V.
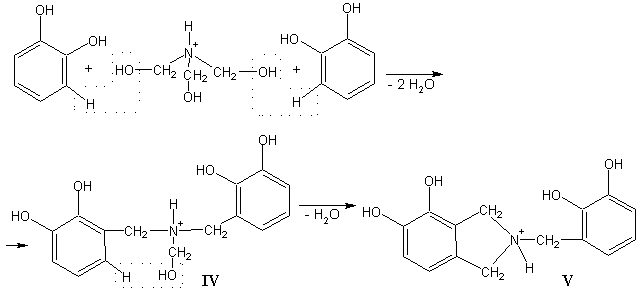
Синтез нітрогенвмісного олігомеру проводили у
середовищі концен-трованої хлоридної кислоти при нагріванні реакційної суміші у
колбі зі зворотним холодильником. Реакція конденсації може бути зображена
наступною схемою з якої випливає також можливість включення атома Нітрогену до
гетероциклічної структури V.
Поряд з цим, утворення фрагментів
типу VІ з метиновими
містками, також є дуже імовірним
VI
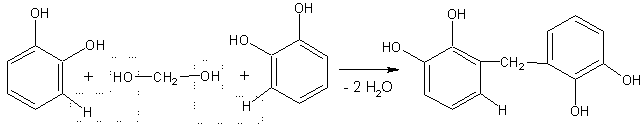
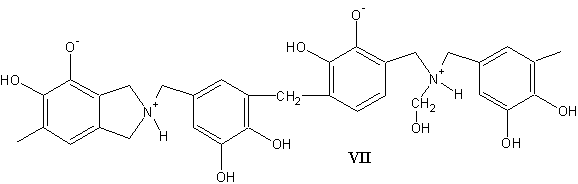
За умови, що константи швидкості цих процесів близькі, вміст
Нітрогену в продукті поліконденсації можна очікувти на рівні 4-7 %, а у
будові – стохастичну нерегулярність чергування метинових і нітроген-вмісних
містків у структурі продукту VII:
Продукт реакції
осаджували, додаючи до реакційної суміші концентрований розчин лугу при інтенсивному перемішуванні до
рН = 8. Суміш олігомерів після промивки водою і висушування при 80 ºС
являє собою нерозчинний у воді порошок жовто-сірого кольору. Він проявляє
амфотерні властивості, розчиняючись у розчинах як кислот, так і лугів, з утворенням
червоно-коричневих розчинів. Цей продукт далі окиснювали молекулярним киснем в
умовах надлишку лугу при кімнатній температурі. Процес вели при
волюмометричному контролі до припинення помітного споживання кисню [3]. Після завершення окиснення
продукт реакції осаджували додаванням розчину концентрованої хлоридної кислоти
до рН = 1,5 при інтенсивному перемішуванні. Продукт відділяли від
маточного розчину фільтруванням під вакуумом, промивали водою до негативної
реакції на хлорид-іон та сушили при 80 ºС. Вміст Нітрогену у продукті,
визначений за методом Дюма, склав 3,5 %.
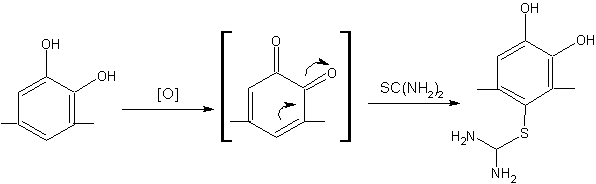 Сульфур до складу
кінцевого продукту можна ввести в процесі окиснення, оскільки хіноїдні
інтермедіати, які виникають при цьому, здатні до приєднання сульфурвмісних
нуклеофілів за Міхаелем [2]. Як нуклеофіл в нашій роботі було використано
тіокарбамід.
Сульфур до складу
кінцевого продукту можна ввести в процесі окиснення, оскільки хіноїдні
інтермедіати, які виникають при цьому, здатні до приєднання сульфурвмісних
нуклеофілів за Міхаелем [2]. Як нуклеофіл в нашій роботі було використано
тіокарбамід.
Виділення сульфурвмісного продукту проводили так, як описано вище. Вміст Сульфуру визначений гравіметричним баритовим методом склав 7,6 %. Щоб довести вміст цього елемента до характерного для ґрунтових гумінових кислот, обидва продукти змішували у масовому співвідношенні 10 : 1, розчиняли у лузі і проводили переосадження хлоридною кислотою. Проміжний амфотерний олігомер та продукти синтезу ГК було охарактеризо-вано за їх рК-спектрами [3]. На рис.1б зіставлено рК-спектри природних гумінових кислот, виділених з грунту, та синтетичних продуктів з Сульфуром і без нього.
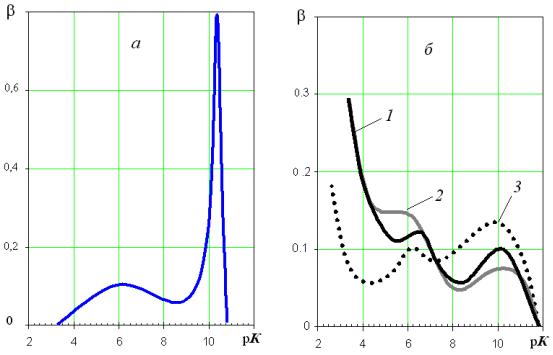
Рис.1.
рК-спектри природних і синтетичних ГК
а – амфотерний олігомер, 1б –
синтетичний аналог ГК без Сульфуру,
2б – грунтові
гумінові кислоти, 3б – синтетичний сульфурвмісний аналог ГК
Зіставлення ІЧ-спектрів природних і синтетичних
гумінових кислот показує наявність у останніх усіх характерних смуг поглинання,
крім смуги при 1021 см–1, яка належить ОН-групам вуглевоних
залишків, присутніх у природних гумінових кислотах.
Література
1. Перминова И. В. Анализ,
классификация и прогноз свойств гумусовых кислот.
Дисертация на соиск. уч. степ.
докт. хим. наук, –М:. МГУ, 2000, -с.319.
2. Исаакс
Н. Практикум по физической органической химии. Перев. с англ.,
под ред. В.С. Петросяна. – М.:
«МИР», 1972, -с.290.
3. Федоренко К. В., Литвин В. А., Галаган Р. Л. Одержання, фракціонування
та дослідження
кислотно-основних властивостей синтетичних аналогів фуль-
вокислот // Materiały IV międzinarodowej naukowi- praktycznej konferencji
«Nauka i inowacja», 9, 2008, Przemiśł, -S 58-65.