Д.х.н., профессор Надиров К.С., к.т.н., доцент Жантасов М.К.,
к.т.н., доцент Бимбетова Г.Ж., к.х.н. Орынбасаров А.К.,
к.т.н., доцент Бажиров Т.С., магистрант Бидасов Ж.М.
Южно-Казахстанский
государственный университет им.М.Ауэзова, Республика Казахстан
Исследование механизма и кинетики
процесса оксиэтилирования жирных кислот госсиполовой
смолы
Оксиэтилированные жирные кислоты (полиоксиэтиленалканоаты)
– это техническое название соединений
общей формулы RCOO (С2Н4О)n Н, где R-алкил,
алкенил С7 и выше, n ![]() 1.
Этоксилаты с узким гомологическим распределением занимают всё большую долю
рынка, в том числе с целью получения неиногенных ПАВ для нефтяной
промышленности. Преимущества таких этоксилатов вследствие особенностей их
свойств несомненны. Реакция оксиэтилирования
достаточно хорошо изучена и широко применяется в промышленном органическом
синтезе [1,2]. Однако данная реакция для оксиэтилирования
жирных кислот (ЖК), выделенных из госсиполовой смолы, была реализована впервые
авторами данной работы [3], поэтому необходимо
проведение теоретических и экспериментальных исследований по изучению
особенностей механизма и кинетики процесса применительно к новому сырью.
1.
Этоксилаты с узким гомологическим распределением занимают всё большую долю
рынка, в том числе с целью получения неиногенных ПАВ для нефтяной
промышленности. Преимущества таких этоксилатов вследствие особенностей их
свойств несомненны. Реакция оксиэтилирования
достаточно хорошо изучена и широко применяется в промышленном органическом
синтезе [1,2]. Однако данная реакция для оксиэтилирования
жирных кислот (ЖК), выделенных из госсиполовой смолы, была реализована впервые
авторами данной работы [3], поэтому необходимо
проведение теоретических и экспериментальных исследований по изучению
особенностей механизма и кинетики процесса применительно к новому сырью.
Оксиэтилированные ЖК в промышленности
получают действием этиленоксида или этерификацией ЖК полиэтиленгликолями. В первом случае
реакцию обычно проводят при 120-200°С и 0,2-0,8 МПа в присутствии оснований (КОН, NaOH,
CH3ONa, R3N); реакция протекает через образование комплексов кислоты
с этиленоксидом или кислоты с ее солью. Побочные продукты - полигликолевые
эфиры ЖК, моно- и диэфиры этиленгликоля, полиэтиленгликоли. Использование в
качестве катализаторов третичных аминов
позволяет подавить образование побочных продуктов лишь на стадии образования
моноэфира (его содержание в реакционной среде достигает 90-98%) [1,2]. Суммарная реакция
конденсации оксида этилена с ЖК протекает через образование
промежуточного комплекса:
 (1)
(1)
Гидрофильной составляющей всех
неионогенных ПАВ являются полиэтиленгликолевые цепи, полученные посредством
последовательного присоединения оксида этилена к гидрофобной составляющей по
месту подвижного атома водорода. Выход продукта зависит от комплекса факторов:
природы стартового вещества, типа катализа, температуры процесса, мольного соотношения реагентов и т.д. [4].
Такая реакция может протекать без
катализатора, при кислотном и основном (нуклеофильном) катализе. Механизм
реакции оксиэтилирования
в присутствии кислотных и щелочных катализаторов различен. В последнем случае
катализатором является основание, сопряженное смеси ЖК - реагентов. Механизм
реакции включает предварительное активирование этиленоксида по его кислородному
атому, что облегчает последующую атаку атома углерода нуклеофилом, идущую с
раскрытием цикла. При этом температуру можно поддерживать на уровне не выше 150оС [5]:
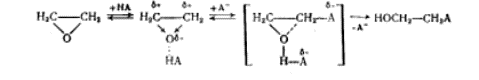 (2)
(2)
Полученные
группировки способны к дальнейшему присоединению молекул этиленоксидов. В
результате происходят последовательно-параллельные реакции с образованием
продуктов всё более высокой степени оксиэтилирования. Именно так получают
неиногенные ПАВ с длинной цепочкой оксиэтильных групп:
 (3)
(3)
При дальнейшем развитии
последовательно-параллельных реакций образуются полимеры высокой молекулярной
массы. Продукты оксиэтилирования состоят из большого числа полимергомологов.
Состав образующихся продуктов и селективность процесса по целевому продукту
зависят от отношения констант скорости последовательных стадий и от соотношения
реагентов [4,5].
Как рассчитано нами, при реализации
первой стадии оксиэтилирования ЖК госсиполовой смолы (рисунок 1), полученные
результаты описываются известным уравнением, которое характеризует
дифференциальную селективность по первому промежуточному продукту:
![]() , (4)
, (4)
где К2/К1- отношение кислотностей
первого продукта и исходной модельной смеси жирных кислот, G и a – постоянные
уравнения Бренстеда.

Реагент: модельные составы сырых ЖК
с содержанием посторонних примесей около 1,2-1,3%
различной кислотности, количество этиленоксидных
групп в продукте – от 5 до 15, 1- нуклеофильный катализ, 2 – некаталитическая
реакция, 3 – кислотный катализ.
Рисунок 1 – Влияние отношения кислотностей полученных
оксиэтилированных кислот и исходного реагента на отношение констант скоростей
последовательного оксиэтилирования ЖК госсиполовой смолы
Из наклона прямых,
изображенных на рисунке 7, рассчитаны значения а, которые составили в
исследованных условиях: при нуклеофильном катализе – 0, 71, при
некаталитической реакции – 0,19, при кислотном катализе – 0,11.
Была выполнена попытка
изучения кинетики оксиэтилирования ЖК госсиполовой смолы, осложненная непростым
и непостоянным составом исходного сырья. Как было показано ранее, состав
очищенной жировой фракции, выделенной из госсиполовой смолы и установленный
методом ГЖХ, можно представить следующим образом, %: ненасыщенные кислоты: линолевая - 31,1, линоленовая - 25,2,
олеиновая - 19,3, насыщенные кислоты: пальмитиновая 18,0, стеариновая – 2,1,
миристиновая - 1,4, арахиновая – 0,5, содержание посторонних примесей
(госсипол, госсипурпурин, эфиры госсипола, замещенные полифенолы, стерины, токоферолы)
около 1,2-1,3%. Именно этот состав был использован в
данном эксперименте. В ходе реакции постоянно осуществлялся контроль за
изменением концентрации ЖК. Расчеты констант скоростей (k) реакций получения оксиэтилированного продукта при
разных температурах проводили по степенному кинетическому уравнению при n=1 (kI), n=2 (kII),
n=3 (kIII):
υ = kCАn , (5)
Исходя из экспериментальных и
рассчитанных значений концентраций, рассчитывали среднеквадратичную ошибку,
определяющую суммарное отклонение рассчитанных значений концентраций от их
экспериментальных величин для кинетических уравнений разного порядка.
Наименьшие среднеквадратичные ошибки наблюдались при описании кинетики реакций
синтеза уравнением второго порядка. Следовательно, скорости реакций, вероятнее
всего, описываются кинетическим уравнением второго порядка. На основании
полученных данных были определены кинетические параметры реакций для этого
предположения, они приведены в таблице 1.
Из данных таблицы 1 можно сделать вывод,
что в исследуемых условиях реакции оксиэтилирования протекают в диффузионной и
переходной областях. Это предположение основано на том, что реакции, проходящие
в кинетической области, характеризуются большими величинами энергии активации –
80-250 КДж/моль. На рисунке 2 показано влияние степени оксиэтилирования на
состав реакционной массы на стадии получения монозамещенного производного ЖК
госсиполовой смолы.
Таблица
1. Кинетические параметры реакции
|
k, л/( моль·мин) |
k0, л/( моль·мин) |
Энергия
активации, кДж/моль |
|
|
0,007 (170ºС) |
0,009 (180ºС) |
878,78 |
41,4 |
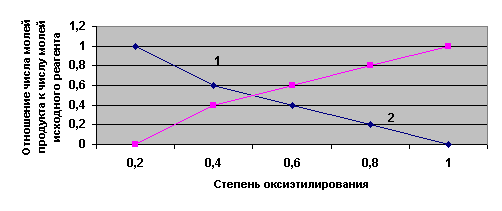
Условия: основной катализ,
температура – 180 оС, давление - 2 МПа,
1 – ЖК, 2 – монозамещенное
производное.
Рисунок 2 – Состав реакционной массы в зависимости от
степени оксиэтилирования
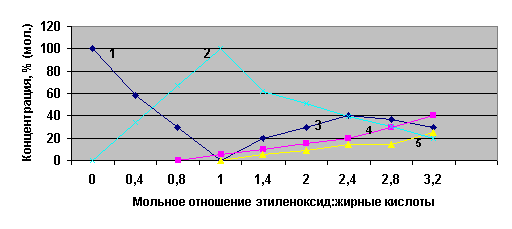
Условия: основной катализ,
температура – 180 оС, давление - 2 МПа,
1- исходные ЖК, 2 – монозамещенное,
3- дизамещенное, 4 – тризамещенное, 5 – тетразамещенное.
Рисунок 3 – Зависимость выхода и состава продуктов
оксиэтилирования от соотношения исходных реагентов
Как следует из данных рисунка 3, в
условиях основного катализа первая стадия присоединения четко отделена от
последующих, первый промежуточный продукт можно получить с выходом, близким к
100%, и только после исчерпания исходных веществ образуются последующие
продукты присоединения этиленоксида, что хорошо согласуется с
экспериментальными данными для процесса оксиэтилирования других ЖК.
Полученные данные по исследованию
кинетики процесса в дальнейшем были использованы при выборе технологических
параметров и аппаратурно-технологического оформления процесса оксиэтилирования
ЖК госсиполовой смолы.
Данные
исследования проводились благодаря финансированию Комитета науки
Министерства образования и науки
РК.
Литература
1. Шенфельд Н. Поверхностно-активные вещества на
основе окисиэтилена / Н. Шенфельд. - Пер. с нем. / Под ред.
Лебедева Н.Н. Изд. 2- е. - М.: Химия. - 1982. - 752 с.
2. Абрамзон
А.А. Поверхностно-активные вещества. Синтез, анализ, свойства, применение /
А.А. Абрамзон, Л.П. Зайченко, С.И. Файнгольд.– Л.: Химия. -1988. – 200 с.
3. Надиров К.С и
др. Деэмульгатор для обезвоживания и обессоливания сырой нефти. Инновац. патент
(19) КZ (13)А4(11)26788. Бюл. № 4. опубл. 15.04. 2013.
4. Новые процессы органического синтеза.//Р.Б.
Серебряков, Р. М. Масагутов, В. Г.
Правдин и др./ Под ред. С. П. Черных. — М.: Химия, - 1989. — 400 с.
5. Лебедев Н.Н. Химия и технология основного
органического и нефтехимического синтеза. – М.: Химия. – 1988. – 592с.