Биричевская Л.Л., д.б.н. Зинченко А.И.
Институт микробиологии НАН Беларуси
Влияние состава питательной среды и условий
культивирования на продуцирование фосфолипазы D культурой
Streptomyces netropsis БИМ
В-235
Фосфолипаза D (ФЛД) – фермент, осуществляющий специфический гидролиз
различных фосфолипидов, а также синтез таких
соединений путем реакции трансфосфатидилирования
(рис. 1).

+ Н−Х
ФЛД
Рис. 1.
Схема реакции трансфосфатидилирования нуклеозидов,
катализируемая ФЛД:
R – ацил; Х – остаток нуклеозида; Y – остаток холина.
Особый
интерес вызывают ФЛД стрептомицетов, обладающие высокой трансфосфатидилирующей
активностью и нетипичной для ферментов широкой субстратной специфичностью.
Указанные свойства позволяет использовать ФЛД в качестве инструмента для
ферментативной модификации фосфолипидов. В частности,
ФЛД микроорганизмов рода Streptomyces способна
синтезировать фосфолипиды, имеющие в своем составе
природные и модифицированные нуклеозиды. Данный ферментативный способ является
достойной альтернативой химическому синтезу этих соединений [1–3]. Нужно
отметить, что фосфолипидные производные нуклеозидов рассматривают как основу
для перспективных лекарственных препаратов нового поколения [4–8].
Приступив
к исследованиям, целью которых является получение эффективного биокатализатора
для ферментативного синтеза вышеупомянутых фосфолипидных производных, среди
ряда проверенных музейных культур стрептомицетов мы отобрали штамм Streptomyces netropsis
БИМ В-235, клетки которого секретируют в культуральную
среду ФЛД, способную катализировать перенос фосфатидильных
групп с лецитина на 5'-гидроксил нуклеозидов [9]. При этом,
удельная активность фермента в составе фильтрата культуральной
жидкости (КЖ) оказалась всего в 250 раз меньше таковой препарата
высокоочищенного фермента (коммерческого препарата фирмы “Sigma”, США), что свидетельствовало, на наш взгляд, о
хороших потенциальных биотехнологических возможностях
отобранного штамма.
В
настоящей работе нами было изучено влияние некоторых компонентов питательной
среды и условий культивирования на образование ФЛД культурой Str. netropsis БИМ В-235. Такие данные
необходимы для создания рациональной питательной среды и подбора условий
выращивания продуцента, обеспечивающих максимально эффективный биосинтез им
ФЛД.
Материалы и методы. В работе
использовали штамм Str. netropsis
БИМ В-235 (далее по тексту Str. netropsis) из Национальной
коллекции непатогенных микроорганизмов Института микробиологии НАН Беларуси.
Культивирование
стрептомицета проводили на орбитальной биологической
качалке при частоте оборотов 170-190 об/мин и температуре 28–30оС в течение 1–7 суток в
250 мл колбах Эрленмейера, содержащих 50 мл
питательной среды. Посевным материалом служила 18-часовая культура в количестве
10% (об.). В качестве исходной
питательной среды (среда I) использовали
мясопептонный бульон (МПБ), в который вносили растворимый крахмал до
концентрации 1% и соли – NaCl и MgSO4x7H2O
до концентрации 0,3 и 0,1% соответственно. Величина рН
среды составляла 7,2. Указанная
среда (с некоторыми модификациями) использовалась Yamaguchi и соавт. [10]
для скрининга ФЛД-продуцирующих стрептомицетов.
В процессе подбора оптимальной питательной среды для синтеза ФЛД исследуемым штаммом
Str. netropsis использовались также
стандартные среды, рекомендованные Международным проектом по стрептомицетам (ISP) для
культивирования и изучения характеристик стрептомицетов:
овсяная среда (ISP № 3),
синтетические – крахмало-аммиачная (ISP № 4), глицерин-аспарагиновая
(ISP № 5) [11] и
глюкозо-аммиачная (ISP № 9) [12] среды (далее среды II, III, IV и V соответственно). Среды VI, VII и VIII в качестве источника азота
вместо (NH4)2SO4 содержали соответственно
NaNO3, NH4NO3 и мочевину в концентрации 0,5%. Остальные компоненты
те же, что и в составе среды V. На первом
этапе исследований в качестве посевного материала для сред I–VIII
использовалась суспензия спор и мицелия, получаемая путем смыва их 10-ю мл
стерильной среды с поверхности 7-суточной культуры Str. netropsis, выросшей
при 28°С в пробирках
объемом 50 мл на поверхности скошенного овсяного агара
(15 мл). Полученный смыв вносили в питательную среду в количестве
10% (об.).
По окончании
культивирования биомассу стрептомицета отделяли фильтрованием
через бязь. Выход биомассы определяли весовым методом после
высушивания ее до постоянного значения при 105ºС. Фильтрат КЖ использовали
в качестве источника ФЛД.
Трансферазную активность ФЛД определяли в реакции переноса фосфатидильного
остатка с лецитина на 5'-гидроксильную группу тимидина
путем инкубирования при 37оС в течение 45
мин реакционной смеси (1 мл), состоящей из 67% хлороформа и 33% водной фазы и
содержащей
Активность ФЛД определяли
за время, при котором выход продуктов не превышал 15–20%.
За единицу активности фермента принимали такое его количество, которое
обеспечивало трансформацию субстрата или образование продукта в количестве 1 нмоль за 1 мин в соответствующих условиях реакции.
Для
характеристики продуцирующей способности микробных клеток в отношении ФЛД её
активность выражали в ед/мг
сухой биомассы, а для характеристики биосинтетической активности культуры в
целом (которая зависит не только от продуцирующей способности клеток, но и от
выхода биомассы) активность фермента приводили в ед/мл
КЖ.
Для описания и анализа
процессов роста культуры и биосинтеза фермента удельную скорость роста (m) и удельную скорость
синтеза фермента (e) вычисляли по
формулам: m = dX×dt-1×X-1 и e = dE×dt-1×X-1 , где X – биомасса, dX – прирост биомассы, dE – прирост
активности фермента за промежуток времени dt [13].
Результаты и их обсуждение. Как известно, уровень биосинтеза ферментов
культурами микроорганизмов зависит не только от генетических особенностей
штаммов-продуцентов, но, в немалой степени, и от условий (в том числе
питательной среды), в которых эти штаммы культивируются.
На
первом этапе при подборе питательной среды для оптимального синтеза ФЛД мы сравнили уровень
продукции фермента культурой Str. netropsis при выращивании на исходной
среде и некоторых средах, рекомендованных ISP для культивирования и изучения характеристик
микроорганизмов рода Streptomyces.
На
всех исследованных синтетических средах наблюдался слабый рост культуры и
отсутствие активности ФЛД в фильтрате КЖ через 7 дней культивирования (табл.
1), тогда как на средах I
и II обильный
урожай биомассы достигался на 2–3-и сутки выращивания. Однако при этом на
овсяной среде, в отличие от среды, использовавшейся для отбора культуры,
обнаружились лишь следовые количества ФЛД-активности.
Таблица 1
Накопление активности ФЛД в КЖ в
процессе роста культуры Str. netropsis на различных средах
|
Среда |
Биомасса,
мг/мл |
Активность
ФЛД, ед/мл |
|
I |
3,3 |
995 |
|
II |
3,7 |
15 |
|
III |
±* |
−** |
|
IV |
± |
− |
|
V |
± |
− |
|
VI |
± |
− |
|
VII |
± |
− |
|
VIII |
± |
− |
Примечания.
* − измерение биомассы не
проводилось в связи с незначительным ее количеством. ** − в данных условиях реакции активность не обнаружена.
Представленные данные
согласуются с результатами, полученными Yamaguchi и соавт. [10].
В этой работе авторы также отмечают отсутствие продукции ФЛД при выращивании
культуры Str. hachijoensis на синтетических средах с минеральными источниками
азота, мочевиной, аспарагином.
Таким образом, в качестве
исходной среды для оптимизации была выбрана среда I (МПБ c водорастворимым
крахмалом), использовавшаяся ранее для отбора штамма-продуцента. Изучение
характера роста Str. netropsis на
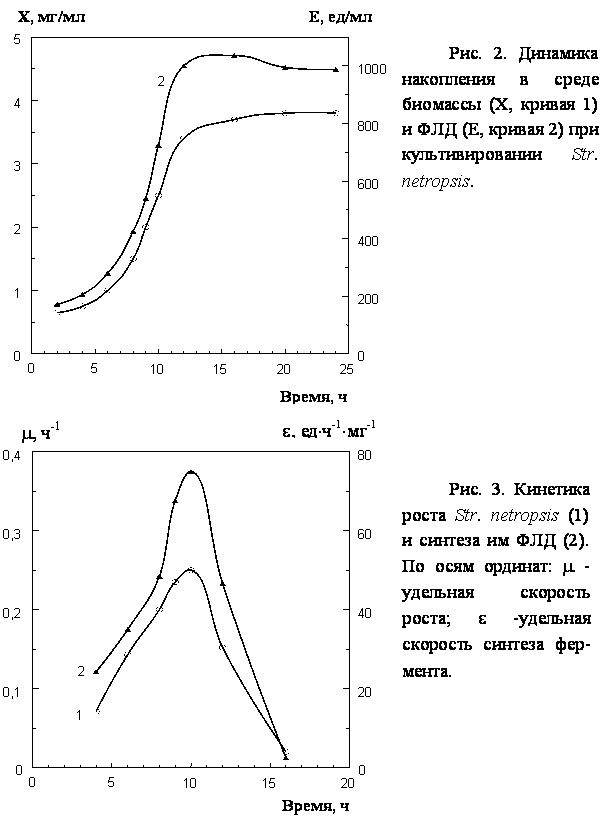
данной среде и образования ФЛД в динамике показало (рис. 2), что накопление
биомассы и изучаемого фермента происходит параллельно, начиная с 5 ч, и
достигает максимальных значений к 14–15 ч роста культуры. Это указывает на то,
что продукция ФЛД связана с экспоненциальной фазой роста культуры.
Анализ
кинетических параметров роста Str. netropsis и синтеза ФЛД показал (рис. 3), что
максимальная удельная скорость роста наблюдается на 10 ч культивирования и
составляет в данных условиях эксперимента 0,25 ч-1. Максимум
удельной скорости синтеза фермента также приходится на 10 ч роста культуры и
составляет 75 ед×ч-1×мг-1.
Это свидетельствует о том, что процессы роста исследуемого штамма и образования
им ФЛД совпадают по времени.
Важнейшими
составляющими культуральной среды для микроорганизмов
являются источники углерода и азота. При изучении взаимосвязи между источниками углерода в среде и
биосинтезом ФЛД нами было испытано 6 соединений (табл. 2). При этом, моно-,
дисахариды и многоатомные спирты вносили в исходную
питательную среду вместо крахмала.
Таблица 2
Влияние источников углерода на
накопление биомассы и ФЛД в процессе роста культуры Str. netropsis
|
Источник углерода, 1% |
Биомасса, мг/мл |
Активность ФЛД |
|||
|
ед/мг
|
% |
ед/мл
|
% |
||
Глицерин
|
5,7 |
238 |
70 |
1360 |
66 |
|
Глюкоза |
6,1 |
340 |
100 |
2070 |
100 |
|
Крахмал* |
3,6 |
285 |
84 |
1030 |
50 |
|
Манноза |
3,1 |
300 |
88 |
930 |
45 |
|
Сахароза |
3,4 |
295 |
87 |
1000 |
48 |
|
Сорбит |
3,1 |
270 |
80 |
840 |
41 |
Примечание. * − вариант, соответствующий исходной питательной среде.
Установлено, что все
источники, кроме глюкозы и глицерина, обеспечивают примерно одинаковый выход
биомассы (в пределах 3,1–3,6 мг/мл). Урожай биомассы на средах с глицерином или
глюкозой был почти вдвое выше. Что касается биосинтетической активности
культуры в отношении ФЛД, вариант среды с глюкозой значительно превзошел все
другие, причем не только из-за более высокого выхода биомассы, но и по причине
более высокой продуцирующей активности мицелия. Следует отметить, что по данным
Yamaguchi и соавт. [10], глюкоза и сахароза являются неподходящими
источниками углерода для продукции ФЛД. Однако другие исследователи часто
используют глюкозу в составе сред для культивирования штаммов-продуцентов ФЛД [14–18].
Помимо источников
углерода, важную роль в синтезе ферментов играют источники азота. В проведенных
нами опытах органические источники азота вводили вместо МПБ в исходную среду с
1% глюкозой (вместо крахмала) в качестве источника углерода. Как
видно из данных, приведенных в табл. 3, все органические источники азота (в
отличие от минеральных) обеспечивали накопление достаточно высокого уровня ФЛД-активности в фильтрате КЖ. Оптимальные
результаты получены при использовании дрожжевого экстракта.
Таблица 3
Влияние органических источников азота
на накопление биомассы и ФЛД в процессе роста культуры Str. netropsis
|
Источник азота, 1% |
Биомасса, мг/мл |
Активность ФЛД |
|||
|
ед/мг
|
% |
ед/мл
|
% |
||
|
Дрожжевой экстракт |
7,3 |
330 |
100 |
2410 |
100 |
|
Пептон |
6,4 |
190 |
58 |
1220 |
51 |
|
Гидролизат казеина |
5,1 |
225 |
68 |
1150 |
48 |
|
Ферментолизат БВК |
3,9 |
320 |
97 |
1250 |
52 |
|
МПБ (контроль) |
6,2 |
330 |
100 |
2050 |
85 |
Примечание. Все среды содержали 1% глюкозы в качестве
источника углерода.
Проверка влияния
различных концентраций глюкозы на биосинтез ФЛД позволила установить (табл. 4),
что максимальное накопление фермента в КЖ происходит при культивировании
продуцента на среде с концентрацией глюкозы, равной 0,5–1%.
Таблица 4
Влияние концентрации глюкозы на
накопление биомассы и ФЛД в процессе роста культуры Str. netropsis
|
Концентрация глюкозы, % |
Биомасса, мг/мл |
Активность ФЛД |
|||
|
ед/мг
|
% |
ед/мл
|
% |
||
|
0 |
4,5 |
425 |
100 |
1920 |
82 |
|
0,5 |
5,9 |
395 |
93 |
2340 |
100 |
|
1,0 |
7,0 |
335 |
79 |
2340 |
100 |
|
2,0 |
7,0 |
290 |
68 |
2030 |
87 |
|
4,0 |
7,2 |
250 |
58 |
1785 |
75 |
Примечание. Все среды
содержали 1% дрожжевой экстракт в качестве источника азота.
Результаты экспериментов
по подбору концентрации дрожжевого экстракта в питательной среде отражены в табл. 5.
Таблица 5
Влияние концентрации дрожжевого
экстракта на накопление биомассы и ФЛД в процессе роста культуры Str. netropsis
|
Дрожжевой экстракт, % |
Биомасса, мг/мл |
Активность ФЛД |
|||
|
ед/мг
|
% |
ед/мл
|
% |
||
|
0,25 |
2,4 |
235 |
46 |
560 |
18 |
|
0,5 |
3,6 |
400 |
78 |
1450 |
48 |
|
1,0 |
5,7 |
425 |
83 |
2420 |
79 |
|
2,0 |
5,8 |
510 |
100 |
2950 |
97 |
|
4,0 |
6,5 |
450 |
88 |
3050 |
100 |
Примечание. Среда содержала 0,5% глюкозы в качестве источника
углерода.
Представленные данные
показали, что с увеличением содержания дрожжевого экстракта в среде показатели
активности изучаемого фермента растут, однако, с точки зрения экономии
субстрата, рационально его вносить в среду в количестве 1–2%.
Еще одним важным
фактором, влияющим на рост и метаболизм микроорганизмов при их глубинном
культивировании, является концентрация кислорода в среде. Для изучения влияния аэрации на развитие культуры изучаемого актиномицета и ее
биосинтетическую активность в отношении ФЛД его выращивали в колбах (250 мл) с
различным объемом питательной среды. Из данных, представленных в табл. 6,
прежде всего, видно, что увеличение степени аэрации среды способствует
накоплению биомассы.
Таблица 6
Влияние аэрации
на накопление биомассы и ФЛД в процессе роста культуры Str. netropsis
|
V/V* |
Биомасса, мг/мл |
Активность ФЛД |
|||
|
ед/мг
|
% |
ед/мл
|
% |
||
|
0,1 |
6,5 |
435 |
63 |
2825 |
96 |
|
0,2** |
5,8 |
510 |
74 |
2950 |
100 |
|
0,4 |
4,3 |
685 |
100 |
2940 |
99 |
|
0,5 |
3,8 |
580 |
85 |
2210 |
75 |
|
0,6 |
2,9 |
535 |
78 |
1555 |
53 |
Примечание. Питательная среда
содержала 0,5% глюкозы и 2% дрожжевого экстракта.
*V/V – отношение
объема питательной среды к объему колбы (250 мл).
** – Стандартные
условия аэрации.
Что касается продуцирующей активности мицелия, то максимальное ее
значение отчетливо выявляется не при максимальной аэрации, а при величине отношения
объема питательной среды к объему колбы, равной 0,4. Однако из-за недостаточно
высокого выхода биомассы в данном варианте, он не является единственно
приемлемым с точки зрения накопления максимального количества фермента в
единице объема КЖ. Практически такие же величины активности ФЛД в ед/мл имеют место и в вариантах с
более высокой аэрацией среды. Тем не менее, представляется целесообразным
использовать в дальнейшей работе соотношение объема среды к объему колбы,
равное 0,4, поскольку этот вариант, практически не отличаясь по выходу фермента
с единицы объема питательной среды от вариантов с более высокой степенью
аэрации, позволяет получать в 2–4 раза более высокий выход фермента с одной
колбы.
В дополнительных экспериментах нами было отмечено, что отсутствие солей MgSO4×7H2O
и NaCl не сказывается на продукции
изучаемого фермента культурой стрептомицета при
выращивании ее в подобранных условиях культивирования.
Таким образом, в
результате проведенных исследований подобрана питательная среда, содержащая (%): глюкозу – 0,5; дрожжевой экстракт – 2,0; (pH 7,2) и степень аэрации среды, обеспечивающие при
культивировании Str. netropsis БИМ В-235,
накопление около 3 тыс. единиц активности ФЛД в 1 мл КЖ. Оптимизация
питательной среды и условий культивирования продуцента позволили в 3 раза увеличить активность фермента в КЖ по
сравнению с исходным уровнем. Установлены некоторые закономерности роста
культуры стрептомицета
и продуцирования ею внеклеточной ФЛД, рассчитаны
кинетические характеристики этих процессов.
Литература:
1.
Shuto
S., Itoh H.,
2.
Shuto
S., Itoh H., Ueda S., Imamura S., Fukukawa
K., Tsujino M., Matsuda A., Ueda T. A facile
enzymatic synthesis of 5'-(3-sn-phosphatidyl) nucleosides and their antileukemic activities // Chem. Pharm. Bull. (
3.
Hayashi M., Itoh
H., Koshio T., Nakagami K.,
Komiyama K. Antitumor activiti
of a novel nucleotide, 5'-(1,2-dipalmitoyl-sn-glycero-3-phospho)-5-fluorouridine
(TJ14026) on murine tumors // Biol. Pharm. Bull.-1993.-Vol. 16, N 8.-P. 778-781.
4.
Alexander R.L., Kucera
G.L. Lipid nucleoside conjugates for the treatment of cancer // Carr. Pharm. Design.-2005.-Vol. 11, N 9.-P. 1079-1089.
5.
Morris-Natschke
S.L., Ishaq K.S., Kucera
L.S. Phospholipid analogs against HIV-1 infection and
disease // Curr. Pharm.
Des.-2003.-Vol. 18, N
9.-Р.
1441-1451.
6.
Mavromoustakos
T., Calogeropoulou T., Koufaki
M., Kolocouris A., Daliani I., Demetzos C., Meng Z., Makriyannis A., Balzarini J., De Clercq E. Ether phospholipids-AZT conjugates
possessing anti-HIV and antitumor cell activity.
Synthesis, conformational analysis, and study of their thermal effects on
membrane bilayers. // J. Med. Chem.-2001.-Vol. 44, N 11.-Р. 1702–1709.
7.
Brachwitz H., Bergmann J., Thomas Y., Wollny T., Langen P. Synthesis and antiproliferative potency of 9-β-D-arabinofuranosyl-2-fluoroadenine phospholopid adducts // Bioorg. Med. Chem.-1999.-Vol. 6, N 7.-Р. 1195–1200.
8.
Водовозова Е.Л., Павлова Ю.Б., Полушкина М.А., Ржанинова А.А., Гараев М.М., Молотковский Ю.Г. Новые фосфолипиды
– ингибиторы репродукции вируса иммунодефицита человека. Синтез и антивирусная
активность // Биоорган. химия.-1996.-Т. 22, № 6.-С.
451-457.
9.
Фещенко Л.Л., Барай В.Н., Ерошевская
Л.А., Зинченко А.И. Первичный отбор продуцентов микробной фосфолипазы
D // Матер. Межд. конф. “Микробиология и
биотехнология на рубеже XXI столетия». Мн.,
10.
Yаmaguchi
T., Okawa Y., Sakaguchi K.,
Muto N. Screening and identification of the phospholipase
D-producing Streptomyces
// Agr. Biol. Chem.-1973.-Vol. 37, N 7.-P. 1667-1672.
11.
Shirling
E. B., Gottlieb, D. Methods for characterization of Streptomyces
species // Int. J. Syst. Bacteriol.-1966.-Vol. 16, Р. 313–340.
12.
Atlas R.M. (1993). Handbook of
Microbiological Media, Parks L.C. (Ed.), CRS Press, Inc.
13.
Terui
G. Kinetics
of hydrolase production by microorganisms // Pure Appl. Chem.-1973.-Vol. 36, N 3.-P. 377-395.
14.
Hatanaka
T., Negishi T., Kubota-Akizawa
M., Hagishita T. Study on thermostability
of phospholipase D from Streptomyces sp. // Biochim. Biophys.
Acta.-2002.-Vol. 1598, N 1-2.-P. 156-164.
15.
Hagishita
T., Nishikawa M., Hatanaka T. Isolation of phospholipase D producing microorganisms with high transphosphatidilatin activiti //
Biotechnol. Lett.-2000.-Vol. 22, N 20.-P. 1587-1590.
16.
Ogino
C., Negi Y., Matsumiya T., Nakaoka K., Kondo A., Kuroda S.,. Tokuyama S., Kikkawa U., Yamane T., Fukuda H. Purification, characterisation, and sequence determination of phospholipase D secreted by Streptoverticillium cinnamoneum
// J. Biochem.-1999.-Vol. 125, N 2.-P. 263-269.
17.
Carrea
G., D’Arrigo P., Secundo
F., Servi S. Purification and applications of phospholipase D from a new strain of Streptomyces // Biotechnol. Lett.-1997.-Vol. 19, N 11.-P. 1083-1085.
18.
Iwasaki Y., Nakano H., Yamane T. Phospholipase D from Streptomyces
antibioticus: cloning, sequencing, expression, and
relationship to other phospholipases // Appl. Microbiol. Biotechnol.-1994.-Vol.
42, N 2-3.-P. 290-299.