УДК 541.128:547.295:542.941
Гидрирование
бензойной кислоты на палладиевом катализаторе модифицированном металлами
VIII группы
Р.А.Рустамбекова, К.Б.Адижоджаева,
Н.О.Джакипбекова,
Д.К.Аргинбаев, Н.Г.Нестеренко
(Южно-Казахстанский государственный университет им.М.Ауезова, г.Шымкент)
При
производстве капролактама по толуольной схеме одной из стадии является
каталитическое восстановление бензойной кислоты циклогексанкарбоновую /1/. Кинетика этой реакции ранее
была изучена на Рt, Рd, Ru катализаторах /2-3/.
В
настоящей работе изучены кинетика и механизм гидрирования бензойной кислоты в
циклогексанкарбоновую на биметаллических (Pd - Me) /С нанесенных катализаторах.
Нанесенные палладиевые катализаторы
готовили методом пропитки на активированном угле /4/. Катализатор
восстанавливали в токе водорода в в течение 2 часов при температуре 200-3500С
в среде н-бутанола в стальной каталитической утке, снабженной стекляной ампулой
с отверстием. Реактор предварительно продували водородом. О протекании реакции
судили по количеству поглощенного водорода. Хроматографический анализ проводили
на колонке 3х3 мм заполненной N-AW-DMCS,
обработанным 10ПЭГА.
Предварительный анализ
кинетических закономерностей показал, что в изученных условиях, скорость гетерогенно-каталитических реакции
пропорциональна поверхностным концентрациям реагирующих веществ и
количеству катализатора:
W = К
[ С6H5COOH] *[РН2] * [Кат] (1)
Поскольку в реакции гидрирования бензола и его гомологов, одним из
определяющих факторов является адсорбция и активация ароматического
кольца на поверхности катализатора, то допускаем, что механизм
гидрирования бензойной кислоты аналогичен механизму гидрирования
бензола. На основании этой аналогии, руководствуясь предложенным
М.И.Темкиным механизмом [5] получаем:
W = 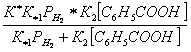
![]() ; (2)
; (2)
где: К — коэффициент пропорциональности;
К1
К2 — константы равновесия стадии.
Полученное
уравнение (1) является частным видом
кинетического
уравнения одномаршрутной реакции на
неоднородной поверхности
выведенного С.Л.Киперманом. Известно также, что опытные данные
по кинетике гидрирования бензойной кислоты в циклогексанкарбоновую
кислоту на
палладиевом катализаторе описываются
уравнением:
W= ![]() (3)
(3)
где: Р и С - давление водорода и концентрация
бензойной кислоты в растворе;
К и К'- коэффициенты пропорциональности.
Этот результат М.И.Темкин объясняет
следующей схемой превращений:
1. ZS + А + H2=Z A H2 + S
2. Z A H2 =ZX
3. ZX +2H2+S = ZS + B,
А + ЗН2 = В
где: Z -
центр адсорбции на поверхности катализатора;
S - молекула растворителя;
X и В - циклогексадиенкарбоновая
и циклогексанкарбоновая
кислоты.
Стадию 3 рассматривают как сумму нескольких быстрых реакций. В схеме
принято, что лимитирующей стадией является присоединение первой
молекулы водорода, обусловленного нарушением энергии сопряжения
ароматического кольца. В связи с этим, после восстановления
водорода в среде растворителя, на поверхности катализатора
становится возможным установление адсорбционного равновесия как
последовательность стадий:
Н2+ Z ![]() HZH
(4)
HZH
(4)
![]() HZH + S HZ'H (5)
HZH + S HZ'H (5)
где: Z и Z' -
активные центры на
поверхности катализатора,
содержащие палладий и молекулу растворителя
соответственно;
S
- растворитель;
Н Z H,
H Z'H — комплексы I и
II соответственно.
При добавлении бензойной кислоты на
поверхности катализатора образуется комплекс III с частичным вытеснением молекул растворителя:
Н Z'H + С6H5COOH ⇔ [ С6H5COOH -Z<11 11 ] + S (6)
Поскольку реакция протекает в жидкой фазе можно
допустить, что активная часть поверхности
катализатора полностью покрыта частицами
[HZ'H] и [С6Н5СООН Z < 11 11 ].
Вытеснение водорода из комплекса HZ'H исключено, так как водород
хемосорбирован, а
каталитически активный центр, согласно правилу 18 - электронов является
координационно-ненасыщенным (Н -Pd - Н, где у Pd - 5 d8 6 s2 -
10 е и у Н - Н → 2 е, всего - 12 е ). Для его
стабилизации необходимо еще 6 е, которые он принимает у молекулы
растворителя или у ароматического кольца бензойной кислоты,
образуя при этом комплекс III, в одной координационной сфере
которого содержатся возбужденное ненасыщенное ароматическое кольцо
и активный водород, что приводит к перегруппировке Н2 с образованием
циклогексадиенкарбоновой кислоты в среде водорода. В отсутствии Н2, в
выведенной кинетической модели уравнения, скорость реакции
не зависит от давления водорода, что очевидно будет противоречить
экспериментальным данным.
Обозначим HZH, HZ'H, С6H5COOH
Z<1111 (n=2,4,6)
через σ1, σ2, σ3, σ4, σ5, σ6 –
соответственно.
Допустим, что скорость реакции определяется
стадией (7): W=K6 σ5 [S]. (7)
По условию
квазистационарности: 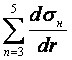 =0
(8)
=0
(8)
Определяем, что: К3σ2 [S] (9)
Равенство (9) означает, что скорость реакции определяется изомеризацией
комплекса ІІІ:
W=К3 σ2 [H2].
Выражая поверхностные концентрации через
объемные получаем:
W=![]() (11)
(11)
Где: К3 =К3
* β (β –
коэффициент пропорциональности; q
- навеска катализатора).
Для вычисления
постоянных уравнений (11) представим
его в линейной форме:
![]() (12)
(12)
Сравнение значений скоростей
определенных экспериментально и вычисленных по уравнению (12) хорошо согласуется в
пределах ошибки эксперимента, что дает
возможность судить о правильности предложенного механизма (табл. 1.).
Зависимость К3 от температуры при
давлении водорода 40-50 атм., в интервале температур 393 - 473 К выражается уравнением:
К3
=2,5 * 10-3 * С - 46721/RT
Значение кажущейся энергии
активации равной 46,721* 103 Дж/моль. а также характер
изменения скорости гидрирования бензойной кислоты в
зависимости от давления водорода и от изменения концентрации непредельного
соединения дают возможность судить о протекании реакции по механизму
Ленгмюра - Хиншельвуда.
Разработанные катализаторы
позволяют сократить расход драгоценного металла в 2 раза. т.е. на 50%, что является экономически
целесообразным при производстве
циклогексанкарбоновой кислоты, которая
является исходным сырьем для получения капролактама, необходимого для
производства нейлона, капрона и других синтетических волокон.
Таблица 1. Значение
констант уравнения (11) и скорости образования циклогексанкарбоновой кислоты (W
при С (С6Н5СООН)=1,0 моль/л
|
Т, К |
К3*104 |
К2 |
Р, атм |
W С6Н5СООН*104,
моль/г*мин |
|
|
эксперимент |
расчет |
||||
|
393 |
1,20 |
18,8 |
10 20 30 40 50 |
6,00 14,40 22,00 32,40 41,00 |
7,6 15,2 25,8 30,8 38,2 |
|
413 |
2,40 |
10,3 |
10 20 30 40 50 |
10,40 24,60 36,70 49,40 62,50 |
11,8 13,6 35,4 47,2 59,0 |
|
433 |
446 |
5,6 |
10 20 30 40 50 |
14,40 28,70 45,60 61,00 76,30 |
15,6 31,3 46,5 64,6 83,5 |
|
553 |
8.00 |
2,6 |
10 20 30 40 50 |
12,80 32,60 48,60 65,20 85,40 |
15,6 31,3 46,5 64,6 83,5 |
ЛИТЕРАТУРА
1.Производство капролактама . / под. ред. Ручинского В.Р. М.: Химия. 1977,
с. 218.
2.Siahl С, Balancccuw I.C. / Hull. Sue.
Soc/ Chun Fnince. 195S. P.684.
3.Макроусов П.В., Tpoфимов и др. Каталитические реакции в жидкой фазе. Алма-Ата: Наука, 1967. с. 169.
4.Мухленов И.П.
Технология катализаторов. Л.: Химия, 1974, с.129.
5.Темкин М.И. и
др. // Кинетика и катализ. 1982. т.23, №4, с.998.
6.Киперман С.Л.
Основы химической кинетики в гетерогенном катализе. М., Химия, 1979. с.345-353.
7.Блек Д.С.,
Джексон У.Р., Свен Дж.Л. Общая органическая химия. М.: Химия, 1984. с.246.