Химия и химические
технологии (5)
*Бондарев Н.В., **Зайцева
И.С.
*Национальный университет им. В.Н.
Каразина, Харьков
**Харьковская национальная академия
городского хозяйства
ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ
КИСЛОТНО-ОСНОВНЫХ РАВНОВЕСИЙ В
МИКРОГЕТЕРОГЕННЫХ СРЕДАХ
Рассматриваются
термодинамические соотношения, характеризующие превращение химической энергии (DGхим) в электрическую (DGэл)
при распределении ионов и молекул (например, красителя НВ) между
объемной (водной, w) фазой и
псевдофазой (микрофазой, мицеллярной
фазой, m) в изотермических условиях.
При установлении
равновесия на границе раздела фаз происходит выравнивание электрохимических
потенциалов ионов (![]() ) и химических потенциалов недиссоциированных частиц (
) и химических потенциалов недиссоциированных частиц (![]() ). Так, для протонов Н+
). Так, для протонов Н+
![]()
![]() или
или ![]() .
.
Откуда 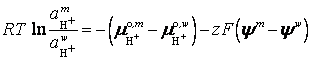 =
= ![]()
или 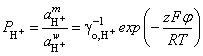 .
.
Аналогично, для анионов индикатора 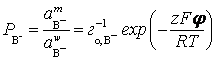 ,
,
а
для молекул индикатора 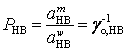 , здесь
, здесь ![]() – равновесные
активности ионов (
– равновесные
активности ионов (![]() ) и молекул (
) и молекул (![]() ) красителя в реальных водных и мицеллярных растворах;
) красителя в реальных водных и мицеллярных растворах; ![]() – стандартные химические потенциалы ионов и молекул;
– стандартные химические потенциалы ионов и молекул; ![]() –
гальвани-потенциал на границе раздела водной и мицеллярной фаз;
–
гальвани-потенциал на границе раздела водной и мицеллярной фаз; ![]() первичный эффект
среды; P – термодинамические
константы распределения.
первичный эффект
среды; P – термодинамические
константы распределения.
Химическая энергия Гиббса
иона Н+ равна
DGхим,H+ = ![]() –
– ![]() = (
= (![]() –
–![]() ) +
) +  .
.
Согласно Н.А. Измайлову
[1], (![]() –
–![]() ) =
) = ![]() , где
, где ![]() – первичный эффект среды для иона H+. Тогда
– первичный эффект среды для иона H+. Тогда
DGхим,H+ = ![]() –
– ![]() =
= 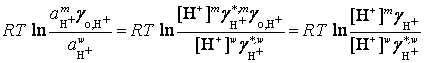 ,
,
здесь ![]() – равновесные концентрации иона H+ в
соответствующих фазах;
– равновесные концентрации иона H+ в
соответствующих фазах; ![]() ,
, ![]() – концентрационные
коэффициенты активности иона H+ в мицеллярной и водной фазах;
– концентрационные
коэффициенты активности иона H+ в мицеллярной и водной фазах; ![]() =
= ![]() – единый
коэффициент активности иона H+.
– единый
коэффициент активности иона H+.
Изменение
энергии Гиббса DGхим,H+
при
распределении ионов H+ между объемной (водной) фазой и псевдофазой
равно изменению DGэл,H+. Тогда
![]()
 ,
,
здесь ![]() –
гальвани-потенциал (общий потенциал двойного электрического слоя), равный
разности внутренних потенциалов мицеллярной
–
гальвани-потенциал (общий потенциал двойного электрического слоя), равный
разности внутренних потенциалов мицеллярной ![]() и водной
и водной ![]() фаз.
фаз.
Из термодинамического
цикла Н.А. Измайлова [1], записанного для кислотно-основных равновесий слабого
электролита (красителя HB) в мицеллярной и водной фазах:
![]()
ВH = B- + H+
(водная фаза, w)
¯ DGхим,BH
¯ DGхим,B- ¯
DGхим,H+
ВH = B- + H+ (мицеллярная фаза, m) ,
![]()
вытекает соотношение DGхим,H+ = 2,303RT![]() + DGхим,BH – DGхим,B-, где
+ DGхим,BH – DGхим,B-, где ![]() ,
, ![]() – термодинамические константы диссоциации индикатора ВH
в органической (мицеллярной) и водной фазах.
– термодинамические константы диссоциации индикатора ВH
в органической (мицеллярной) и водной фазах.
Таким образом,
взаимосвязь термодинамических констант диссоциации красителя ВH в водной фазе (![]() ) и псевдофазе (
) и псевдофазе (![]() ), потенциала двойного электрического слоя (
), потенциала двойного электрического слоя (![]() ), эффектов среды (
), эффектов среды (![]() ), равновесных концентраций ([i]) и концентрационных коэффициентов активности (
), равновесных концентраций ([i]) и концентрационных коэффициентов активности (![]() ) реагентов описывается уравнением:
) реагентов описывается уравнением:
![]() =
=
![]() +
+ 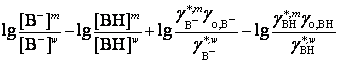 .
.
Обычно
при рассмотрении кислотно-основных равновесий и равновесий распределения в
качестве стандартного состояния для компонентов раствора выбирают гипотетический
идеальный раствор единичной концентрации в выбранной концентрационной шкале,
обладающий свойствами предельно разбавленного раствора.
В этом случае константа
распределения определяется энергией Гиббса пересольватации частиц (первичными
эффектами среды)
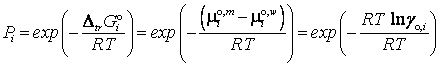 =
=
![]()
Тогда
для диссоциации красителя и распределения частиц между водной и мицеллярной
фазами в стандартных условиях имеем:
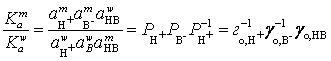 или
или 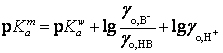
При установлении
равновесия на границе раздела фаз электрохимические потенциалы ионов H+ в
водном и мицеллярном растворе равны и для стандартных растворов можем записать ![]()
Таким образом, 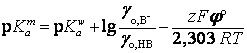
где
![]() - стандартный
гальвани-потенциал, равный разности внутренних потенциалов водной и мицеллярной
фаз в стандартных условиях.
- стандартный
гальвани-потенциал, равный разности внутренних потенциалов водной и мицеллярной
фаз в стандартных условиях.
1.
Измайлов
Н.А. Электрохимия растворов. Харьков: Изд-во ХГУ, 1959. 960 с.
ЗАЯВКА НА УЧАСТИЕ В КОНФЕРЕНЦИИ
"Научное пространство Европы – 2007"
Украина, Днепропетровск
16-30 апреля 2007год.
1. Бондарев Н.В. – к.х.н., доцент, доцент
кафедры физической химии, Харьковский национальный университет им. В.Н. Каразина,
61077, г. Харьков, пл. Свободы, 4, тел. (057)707-54-45, Е-mail: bondarev_n@rambler.ru
2. Зайцева И.С. – к.х.н., старший
преподаватель, Харьковская национальная академия городского хозяйства, 61002,
г. Харьков, ул. Маршала Бажанова, 17, тел. (057)707-31-01