Химия
и химические технологии/1. Пластмассы, полимерные и
синтетические материалы
Сейлханова Г.А., Оспанова А.К., *Бектуров
Е.А., Ашимхан Н.С.,
Казахский национальный университет имени аль-Фараби, Казахстан
*Научный институт новых
технологий, Казахстан
Полиакриламидные комплексы ионов
Mn2+, Fe3+, Co2+, Ni2+
В данной статье представлены результаты
физико-химического исследования реакций взаимодействия ионов Mn2+, Fe3+, Co2+, Ni2+ с полиакриламидом (ПАА), в настоящее время широко
применяемого, в частности, в процессах качественной водоподготовки. Анализ
литературы указывает на наличие нескольких работ по изучению
комплексообразования ионов железа с ПАА, в которых установлен состав
координационного соединения, его концентрационная устойчивость [1]. Однако для
практического приложения результатов научной работы необходимо знание
термодинамических характеристик реакций, которые позволяют создать правильное
представление о механизме сложного химического превращения, выяснить
экономическую целесообразность его ведения, решить вопросы оптимального
управления.
На основе анализа кривых
потенциометрического, кондуктометрического титрования полимерного лиганда
солями указанных металлов были найдены
оптимальные мольные соотношения реагирующих компонентов (k=[M2+]/[ПАА]). Так в системе ПАА- Fe3+ координационное число иона металла равно шести, а для
систем с участием двухзарядных катионов – четырем. В силу стерических
затруднений можно предположить, что координация ПАА осуществляется, вероятно,
по азоту и по кислороду амидной группы полимера. В пересчете на одно мономерное
звено макромолекулы получается, что в системе ПАА-Fe3+
образуется комплекс состава 3:1, ПАА-Ni2+, ПАА-Co2+, ПАА- Mn2+ состава 2:1.
Модифицированным
методом Бьеррума рассчитаны средние координационные числа ионов металлов, а
также константы устойчивости полиакриламидных комплексов железа, марганца,
кобальта, никеля при нескольких температурах (298, 308, 318 К) и значениях
ионной силы раствора (0,1; 0,25; 0,5; 0,75; 1,0), которые представлены в таблице
1 (на примере полиакриламидных комплексов при Т=318 К и I=1,0).
Таблица 1 - Рассчитанные величины функций образования
Бьеррума для систем ПАА-Мn+ (М = Mn2+, Fe3+, Co2+, Ni2+ ) при Т=318 К,
I=1,0
|
|
|
|
|
|
|
ПАА-NiCl2 |
||||
|
5,24·10-5 |
1,64·10-4 |
3,11·10-3 |
3,78 |
3,75 |
|
5,39·10-5 |
5,30·10-5 |
3,22·10-3 |
4,28 |
3,88 |
|
1,41·10-4 |
7,26·10-5 |
3,12·10-3 |
4,14 |
3,76 |
|
2,34·10-4 |
8,22·10-5 |
3,01·10-3 |
4,09 |
3,63 |
|
3,29·10-4 |
8,69·10-5 |
2,91·10-3 |
4,06 |
3,51 |
|
4,22·10-4 |
8,82·10-5 |
2,82·10-3 |
4,05 |
3,4 |
|
ПАА-FeCl3 |
||||
|
2,54·10-5 |
5,99·10-8 |
3,3·10-3 |
7,22 |
5,99 |
|
1,33·10-4 |
6,94·10-7 |
3,2·10-3 |
6,16 |
5,71 |
|
2,79·10-4 |
2,58·10-6 |
2,7·10-3 |
5,59 |
4,84 |
|
6,76·10-4 |
4,47·10-6 |
2,2·10-3 |
5,35 |
3,98 |
|
1,06·10-3 |
6,35·10-6 |
1,7·10-3 |
5,19 |
3,11 |
|
1,46·10-3 |
7,79·10-6 |
1,3·10-3 |
5,10 |
2,28 |
|
ПАА-CoCl2 |
||||
|
1,35×10-5 |
1,91×10-4 |
3,13×10-3 |
3,72 |
3,76 |
|
1,64×10-4 |
7,34×10-4 |
2,43×10-3 |
3,13 |
2,93 |
|
3,38×10-4 |
8,19×10-4 |
2,17×10-3 |
3,09 |
2,62 |
|
4,91×10-4 |
6,45×10-4 |
2,19×10-3 |
3,19 |
2,64 |
|
6,37×10-4 |
5,43×10-4 |
2,15×10-3 |
3,26 |
2,59 |
|
7,64×10-4 |
4,32×10-4 |
2,13×10-3 |
3,36 |
2,57 |
|
ПАА-MnCl2 |
||||
|
3,55×10-5 |
1,72×10-4 |
3,12×10-3 |
3,76 |
3,8 |
|
1,36×10-4 |
3,29×10-4 |
2,86×10-3 |
3,48 |
3,5 |
|
3,04×10-4 |
4,65×10-4 |
2,56×10-3 |
3,33 |
2,9 |
|
4,64×10-4 |
4,85×10-4 |
2,38×10-3 |
3,31 |
2,7 |
|
6,21×10-4 |
4,77×10-4 |
2,23×10-3 |
3,32 |
2,4 |
|
7,90×10-4 |
5,08×10-4 |
2,03×10-3 |
3,29 |
1,9 |
Как видно из
таблицы, координационное число иона железа в комплексе равно шести, ионов
марганца, кобальта, никеля – четырем. По мере увеличения в растворе
концентрации кислоты происходит разрушение координационной связи металл-лиганд,
вследствие протонирования последнего, что подтверждается уменьшением функции
образования Бьеррума и количества закомплексованных функциональных групп, а
также повышением числа протонированных групп полимера.
На основании
результатов проведенных исследований с учетом литературных сведений можно
предложить следующие схемы образования полиакриламидных комплексов ионов Mn2+, Fe3+, Co2+, Ni2+:
Система ПАА-Fe3+
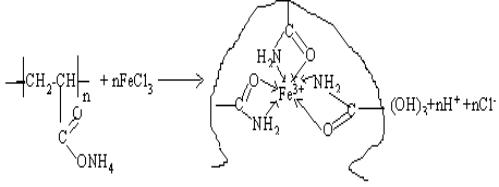
Системы ПАА-М2+
(М = Ni2+, Mn2+, Co2+)
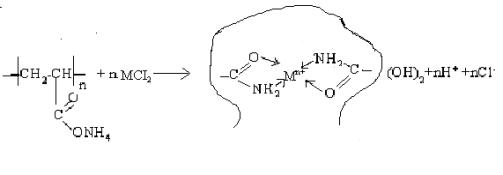
Определены
концентрационные и термодинамические константы устойчивости полиакриламидных
комплексов при нескольких значениях температуры и ионной силы раствора, которые
представлены в таблице 2.
Сравнение
концентрационных констант устойчивости исследуемых координационных соединений
при разных ионных силах раствора указывает, что с ее повышением прочность
полиакриламидных комплексов железа, марганца, кобальта, никеля увеличивается. Как правило, добавки неорганических электролитов
улучшают флокулирующее действие незаряженных и заряженных полимеров [2, 3]. При
добавлении электролитов происходит снижение агрегативной устойчивости системы
за счет сжатия двойного электрического слоя и снижения потенциала и заряда
поверхности. При этом уменьшается радиус действия ионно-электростатических сил
отталкивания между частицами, и создаются условия для сближения реагентов.
Таблица 2 – Константы устойчивости (lgβ)
полиакриламидных комплексов Mn2+, Fe3+, Co2+, Ni2+
|
T, K |
I |
lgβ |
|||
|
ПАА-Fe3+ |
ПАА- Ni2+ |
ПАА-Co2+ |
ПАА-Mn2+ |
||
|
298 |
0 0,1 0,25 0,5 0,75 1,0 |
19,81±0,21 31,22±0,33 32,61±0,33 40,24±0,41 |
10,15±0,11 10,20±0,10 10,39±0,11 10,48±0,11 10,63±0,12 10,90±0,12 |
8,93±0,10 9,01±0,10 9,36±0,10 9,91±0,11 10,03±0,11 10,55±0,11 |
7,97±0,09 8,39±0,09 8,47±0,08 8,62±0,09 9,15±0,10 10,23±0,11 |
|
308 |
0 0,1 0,25 0,5 0,75 1,0 |
21,93±0,22 27,42±0,29 28,65±0,30 39,52±0,41 |
10,26±0,11 10,31±0,11 10,49±0,12 10,61±0,12 10,95±0,11 11,02±0,12 |
10,02±0,11 10,18±0,11 10,61±0,11 10,80±0,12 10,90±0,11 10,95±0,12 |
9,34±0,10 9,38±0,09 9,68±0,10 9,73±0,11 9,80±0,11 10,31±0,12 |
|
318 |
0 0,1 0,25 0,5 0,75 1,0 |
26,51±0,28 26,77±0,28 27,06±0,29 28,82±0,30 |
11,44±0,12 11,50±0,12 11,83±0,13 11,86±0,12 12,07±0,12 12,54±0,13 |
10,52±0,11 10,57±,11 10,66±0,12 10,83±0,12 10,97±0,12 11,08±0,12 |
9,83±0,10 10,08±0,11 10,15±0,11 10,28±0,12 10,56±0,12 11,27±0,13 |
Как видно из таблицы, увеличение
температуры оказывает благоприятное
влияние на стабильность полиакриламидных комплексов, обусловленное
повышением комплексообразующей способности лиганда, вследствие разрушения
водородных связей, а также гидратных оболочек функциональных групп
макромолекулы. Кроме того, необходимо отметить, что увеличение температуры
приводит к усилению гидрофобных взаимодействий в макромолекуле, поскольку они
характеризуются эндо-эффектами [4]. Как известно, в стабилизации
полимерметаллических комплексов, могут принимать участие ковалентные связи, электростатические силы,
водородные связи, а также гидрофобные взаимодействия.
Полиакриламидный комплекс железа является
более прочным координационным соединением в рассматриваемом ряду. Это
обусловлено рядом причин. Во-первых,
ионы железа реализуют в комплексе координационное число равное шести в отличие
от ионов двухзарядных катионов. Известно, что комплексы, в которых центральные
ионы связаны с большим числом лигандов являются более прочными [5].
Во-вторых, координационные соединения,
в которых заряд иона металла выше, также являются более стабильными. Кроме
того, для элементов с переменной валентностью происходит повышение жесткости с
ростом степени окисления. Поэтому в соответствии с принципом ЖМКО Пирсона ионы Fe3+
являются жесткими, тогда как ионы Mn2+, Co2+, Ni2+
представляют собой промежуточные кислоты. Сравнительный анализ прочности
полиакриламидных комплексов рассматриваемых двухзарядных катионов указывает на
их монотонное повышение в ряду Mn2+< Co2+< Ni2+. Это
согласуется с известным рядом Ирвинга-Вильямса, а также с теорией кислот и
оснований М.И. Усановича [6].
Литература:
1.
Кудайбергенов С.Е.,
Фролова В.А., Канапьянова Г.С., Кабо В.Я., Бектуров Е.А. Изучение
комплексообразования гидролизованных ПАА с хлоридом железа III // Известия НАН РК. - № 2. - 1987. - С. 35-38.
2.
Кабо В.Я. Поведение
полиакриламидов в растворах низкомолекулярных солей: автореф. …канд. хим. наук.
– Уфа,1984. - 19 с.
3. Мягченков В.А., Барань Ш., Бектуров Е.А., Булидорова
Г.В. Полиакриламидные флокулянты. – Казань, 1998. - 288 с.
4. Бектуров Е.А., Сулейменов П.Э. Полимерные гидрогели. – Алматы: Гылым, 1998. – 256 с.
5. Дятлова Н.М., Темкина В.Я., Попов К.И. Комплексоны и
комплексонаты металлов. – М.: Химия, 1988. – 544 с.
6. Усанович М.И.
Опыт химической теории растворов // Сборник трудов II Всес. конф. - Алма-Ата, 1971. - С. 5-18.