К.х.н. Мазова О.В., Емельянцев Д.Л., Волкова О.Г. , Власова Л.Ш.
Российский государственный
университет имени Иммануила Канта
Калининград,
Россия
Синтез производных на основе фенотиазина и хинонов
N-замещенные производные фенотиазина и хинонов обладают
многообразным физиологическим действием
и являются потенциальными
носителями биологической активности.
Фенотиазин, как инсектицид
токсичен для личинок москитов. Им обрызгивают
плоды, но он не воздействует вредно на листву. В этом случае он
окисляется in vivo до тионола-лейкотионола. Эффективные дозы фенотиазина, как противоглистного препарата,
значительно меньше порогового предела, так как он обладает очень малой
токсичностью для теплокровных животных. Однако продолжительное воздействие
таких препаратов может вызвать понижение содержания гемоглобина и числа
эритроцитов. Фенотиазин выделяется из
организма теплокровных в виде соединений лейкотионола или в неизмененном виде.
Однако, ни одно из известных производных фенотиазина не отвечает полностью
требованиям практической ветеринарии.
В настоящее время известно много модифицированных форм на основе
фенотиазина, используемых как красители для конкретных целей [1,2]. Так,
феназтиониевая соль - тетраметилтионин
(или метиленовый голубой) относится к избирательными биологическими красителями, благодаря
дифференциации клеточных ядер при витальном окрашивании нервной ткани. Тетраметилтионин,
в виде двойной соли с хлоридом цинка, применяется для окрашивания тканей в голубой цвет, устойчивый на свету и даже при воздействии хлорки.
Михаэлис подробно определил условия существования семихинонов
феназтиониевых солей, таких как метиленовый голубой, тионин, тионил. А Пуммер
показал, что сочетание о- и п-хиноидных резонансных структур, придает меньшую
стабильность молекулам феназтиониевых солей. Это выражается в легкой
гидролизуемости метиленового голубого или в деметилировании его при окислении
(даже на воздухе), что объясняет присутствие в нем азуров, метиленового
фиолетового и образованием солей семихинона и мерихинона, появление которых и
объясняет изменение цвета [2]. Феназтиониевые соли светочувствительны, особенно к красным компонентам света. Будучи
нанесены на поверхности желатинового слоя, они образуют фотографическое
изображение после экспозиции на свету и обработки нитратом серебра.
Известен фармакологически
активный аналог фенотиазина -
хлорпромазин или
2-хлор-10-(3-диэтиламинопропил)-фенотиазин. Открытие хлорпромазина и его
аналогов явилось фактом огромной важности в развитии современной фармакологии.
Он обладает ганглиотическим, адренолитическим, антифибриллярным,противоотечным,
противосудорожным, противолихорадочным действием [1].
Введение линейно аннелированного бензольного кольца в структуру фенотиазина существенно изменяет его спектральные свойства
[2,3]. Те из N-замещенных фенотиазинов,
в состав которых входят фрагменты антрахинонов,
используются для нужд оптоэлектроники. Производные антрахинона,
содержащие имино- и гидрокси- группы, обладают флуоресцентными свойствами[4].
Их применяют для регистрации и при обработке оптической информации, в том числе средствами голографии, введение которых
в среду жидкого кристалла, обеспечивает получение контрастного изображения в
электрооптических индикаторах. Исследование фотохимических процессов
антрахиноидных структур открыло путь новым практически важным технологиям. Японские исследователи установили, что фенотиазин
служит ловушкой положительного заряда в модифицированных фотосенсибилизаторах на основе ДНК[5].
С другой стороны, структуры хиноидного типа широко распространены в
природе. Это природные биоантиоксиданты. Они легко связываются с белками, присоединяясь к свободным амино- и
сульфгидрильным группам, являются переносчиками электронов в дыхательной, фотосинтетических биологических системах.
Хиноны относятся к своеобразными циклическими ненасыщенными дикетонами, а 1,4-нафтохиноны можно рассматривать как
аналоги α,β-ненасыщенных кетонов с открытой цепью. Однако, они
обладают бóльшей реакционной способностью. Среди замещённых 1,4-нафтохинонов немало веществ с высокой
антиоксидантной, антирадикальной, антимикробной и другими видами активности.
Особенностью хиноидных соединений является
способность обменивать кольцевые заместители, не нарушая хиноновой
структуры и специфический характер реакций [4,6].
Можно ожидать, что синтезированные вещества на основе производных фенотиазина,
нафто- и антрахинонов будут обладать
биологической активностью или свойствами
фотохромных и жидкокристаллических веществ, что определит
их дальнейшее практическое применение.
Нами был использован фенотиазин марки «хч» (т.пл.185-187
ºС). По ранее отработанным методикам [7] нами были получены 1,4-нафтохинон
(т.пл.125ºС, выход 75%); его эпоксид (т.пл. 133ºС, выход 45%)[8]; 2
-бром-1,4-дигидронафталин (т.пл. 247ºС,выход 47%), с последующей
перекристаллизацией из гексана; 9,10-антрахинон (т.пл. 270-271ºС,выход 70%). Аддукты : I - антрацена
и 1,4-бензохинона (206-209 ºС, выход
58%), II - антрацена и малеинового ангидрида (285-286 ºС, выход 72%) были получены в результате
диенового синтеза Дильса-Альдера в
среде ксилола и перекристаллизацией из ледяной уксусной кислоты. Аддукт антрацена
и 1,4-бензохинона был окислен хромовым ангидридом в слабо кислой
среде, при осторожном нагревании и тщательном перемешивании в течение 3,5 часов
до образования эндо-4α,9,9α,10–тетрагидро-9,10-(о-фенилен)-1,4-антрахинона
(т.пл.254ºС, выход 62%). Затем
его обработали раствором брома в хлороформе и
получили оранжевые кристаллы эндо-2-бром-4α,9,9α,10–тетрагидро-9,10-(о-фенилен)-1,4-антрахинона (т.пл.321°С;
выход 50%)[8] .
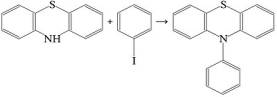
Взаимодействие между хинонами и
фенотиазином осуществляли в 20%
спиртовом растворе
диметилформамида. Выбор условий
ограничен плохой растворимостью фенотиазина в большинстве растворителей. Поскольку известно, что фенотиазин в реакции
Ульмана, в среде ДМФА присоединяет бензольное кольцо в положение
10 с образованием 10-фенилфенотиазина, то и был выбран ДМФА:
Для проведения синтеза
реакционную смесь нагревали 100-105°С в течение 12
часов в колбе с обратным холодильником при тщательном механическом
перемешивании. Причем по мере расходования
растворитель постоянно добавляли в реакционную среду. Продукты промывали в СС14 .Очистку
полученных веществ производили перекристаллизацией из этанола.
Таблица.Сведения о производных на основе фенотиазина
и нафто- и антрахинонов.
|
Название |
Вид осадка |
Выход,% |
Т.пл., 0С |
Содержание найдено / вычислено, в % |
|||
|
С |
Ν |
Br |
S |
||||
|
3-(N-фенотиазинил)-1,4-нафтохинон |
черные кристаллы |
65 |
155-157 |
3,42/3,51 |
3,85/4,10 |
- |
8,89/9,38 |
|
3-(N-фенотиазинил)-1,4-дигидронафталин |
черные кристаллы |
65 |
133-135 |
3,30/3,24 |
3,9/4,12 |
- |
9,11/9,45 |
|
2-бром-3-(N-фенотиазинил)-1,4-дигидронафталин |
сине-серые
кристаллы |
65 |
165-167 |
2,41/2,60 |
2,64/2,00 |
19,72/ 21,00 |
7,21/7,09 |
|
2-бром-3-(N-фенотиазинил)-1,4-нафтохинон |
зеленые
кристаллы |
60 |
174-175 |
2,62/2,70 |
2,95/3,09 |
18,64/ 21,00 |
6,9/17,1 |
|
2,6 -ди-(N-
фенотиазинил)-1,4-дигидронафталин |
сине-серые
кристаллы |
65 |
158-160 |
2,00/2,16 |
4,03/4,15 |
- |
11,45/11,50 |
|
2,6-ди(N-фенотиазинил)- 1,4-нафтохинон |
серые
кристаллы |
60 |
162-164 |
2,1/2,1 |
5,0/5,0 |
- |
11,3/11,5 |
|
2,6-ди-(N-фенотиазинил)-3-бром-1,4-дигидронафталин |
серо-
зеленые кристаллы |
65 |
151-153 |
1,7/1,8 |
4,98 |
13,0 |
6,1 |
|
2,6-ди-(N-фенотиазинил)-3-бром-1,4-нафтохинон |
темно-зеленые
кристаллы |
60 |
177-179 |
1,8/1,9 |
4,5 |
12,8/ 14,0 |
9,8/9,9 |
|
3-(N-фенотиазинил)-1,4-диацетоксинафталин |
черные
кристаллы |
60 |
167-169 |
2,6/2,7 |
2,9/3,0 |
- |
7,1/7,1 |
|
2-(Ν-фенотиазинил)-нафтохинон* 2-(Ν—фенотиазинил)-1,4-дигидронафталин |
бежево-розовые
кристаллы |
50 |
249-251 |
2,0/2,1 |
2,2/2,3 |
- |
5,6/5,7 |
|
3-(Ν-фенотиазинил)-5,6-(9,10
-антрил)—1,4-дигидробензол |
сине-зеленые
кристаллы |
60 |
129-130 |
2,3/2,4 |
2,9/3,0 |
- |
6,5/ 6,6 |
|
3-(Ν-фенотиазинил)-5,6-(9,10
-антрил)— 1,4-диацетоксибензол |
зеленые
кристаллы |
65 |
134-135 |
1,9/2,0 |
2,4/2,5 |
- |
5,3/5,6 |
|
2,3-(9,10-антрил)-4- ( Ν-фенотиазинил)сукцинат |
коричн. кристаллы |
80 |
145- 146 |
2,8/2,9 |
2,9/3,0 |
- |
6,8/6,9 |
|
2-(Ν-фенотиазинил)- 9,10-антрахинон |
желтые кристаллы |
75 |
132- 134 |
3,103,3 |
3,1/3,4 |
- |
7,6/7,9 |
|
2-N-фенотиазинил- антрагидрохинона-9,10 |
коричнев. кристаллы |
30 |
230-232 |
3,0/3,1 |
3,0/3,4 |
|
7,5/7,9 |
|
2-N-фенотиазинилантра- хинона-9,10 * *2-N-фенотиазинил- антрагидрохинона-9,10 |
розовые иглы |
62 |
255-257 |
1,7/1,8 |
2,1/2,2 |
- |
4,7/4,8 |
С
химической точки зрения, фенотиазин
обладает свойствами ароматических соединений. В процессах нуклеофильного
присоединения фенотиазин участвует как гетероциклический амин в конфигурации H-intra, поскольку
является высокоэлектроноизбыточным соединением, а с различными акцепторами образует комплексы
с переносом заряда (КПЗ). Стабильность молекулы фенотиазина обеспечивается с
одной стороны влиянием двух бензольных колец, с другой стороны существенным
нарушением геометрии центрального ядра тиазина[9,10].
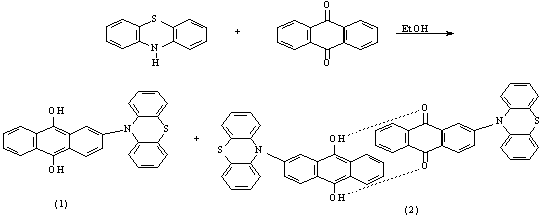
При взаимодействии эквимольных количеств фенотиазина и антрахинона были
выделены: коричневый
кристаллический осадок (1) 2-N-фенотиазинил-антрагидрохинона-9,10 и
розовые игольчатые кристаллы (2) размером
около 8мм 2-N-фенотиазинилантрахинона-9,10*2-N-фенотиазинилантрагидрохинона-9,10:
Наличие двух карбонильных групп у
антрахинона приводит к снижению электронной плотности всех положений в
бензольных ядрах, что дезактивирует антрахинон в реакциях электрофильного
замещения. С другой стороны, реакции присоединения по карбонильной группе для
антрахинона не характерны. По этой причине, реакция между антрахиноном и
фенотиазином, как гетероциклическим амином,
протекает по механизму нуклеофильного присоединения. А продукты реакции были выделены в виде –
розовых игл (2) промежуточного семихинонового комплекса с переносом заряда (КПЗ) . При нагревании розовых
кристаллов наблюдали изменение их окраски
от красной до золотистой при 225°С.
Синтез окиси нафтохинона с
фенотиазином проходит легко. Высокая реакционная способность эпоксисоединений
объясняется сильным искажением валентных углов в трехчленном окисном цикле и
возникающем из-за этого напряжения, что влечет
за собой легкое раскрытие цикла, присоединение фенотиазина и отщепление
воды.
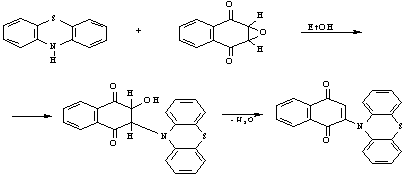
Были
выделены бежево-розовоые кристаллы (КПЗ)
(т.пл.=240-2510С, выход 50%)
2-N-фенотиазинилнафтохинон*2N-фенотиазинилнафтогидрохинона.
Все полученные соединения представляют собой кристаллические
окрашенные соединения, растворимые в
концентрированной серной кислоте, образуя цветные растворы, характерные для
фенотиазина и соединений с кратными связями, но не растворяются в воде. В ИК-области
спектра (диск с бромидом калия) полученные соединения имеют основные пики при
1640,1587, 1460,1380, 1269 и 1446 см‾¹(С-N в гетаренах), 3500, 3414,3342,3890 см‾¹(О-Н в
фенолах), 1770,1760 см‾¹(С=О хинонов),
1000, 990 см‾¹( С-Ѕ в гетаренах), что
не противоречит предполагаемым структурам.
Присутствие фенотиазина
также было подтверждено с помощью цветных реакций — при добавлении
раствора хлорида железа (III) содержащие фенотиазин растворы приобретают зелёную окраску,
при добавлении перекиси водорода — красную и с реактивом FPN - красное,
розовое, голубое или красно-фиолетовое окрашивание, в зависимости от
заместителей.
Литература
1. Машковский М.Д. Лекарственные средства. Т.1 –М.: ООО
«Издательство Новая волна», 2000, -540 с.
2.
Иванский В.И. Химия гетероциклических соединений. Учебное пособие для
университетов. -М.: Высшая школа, 1978, -559 с.
3. Файн В.Я.,
9,10-Антрахиноны и их применение. -М.; Центр фотохимии РАН, 1999, 92с.
4. Л.А.Литвинова, Н.А.Жукова,
С.А.Ляхов, Л.С.Садченко,
Б.Н.Галкин, О.Г.Ясинская, В.П.Курченко, М.М.Козловский «Синтез и биологическая
активность производных аминоантрахинонов»
- Тезисы докладов Всесоюзной конференции по химии хинонов и хиноидных соединений» - Красноярск, 1991
5. Nature Chemistry, 2009, DOI: 10.1038/NCHEM.171
6. Кутырев А.А., Москва В.В. Нуклеофильные
реакции хинонов. // Успехи химии, Т.60, вып.1, 1991, С.163-167.
7. Мазова О.В., Волкова О.Г. Пикта С.И. Синтез
новых производных на основе 2-амино-4-метилтиазола, фенотиазина и галогензамещенных хинонов. В кн.: Материалы международной
научно-практической конференции «Дни науки-2005». Т.47. Химия. Днепропетровск: Изд-во Наука i ocвiта, 2005, С.52-55.
8. Вейганд-Хильгетаг. Методы эксперимента
в органической химии/ пер.с нем. Л.В.Коваленко, А.П.Залиене, под ред Н.Н.Суворова.
-М.; Химия, 1968, -701с.
9. Китайгородский А.И., Зоркий
П.М. и др. Строение органических веществ.-М.: Наука, 1980, -646 с.
10. Рыжаков А.В., Алексеева
О.О. Родина Л.Л. О роли КПЗ в реакциях нуклеофильного замещения в ряду ароматических
N-оксидов. // ЖОрХ,1994, Т.30, Вып.9, С.1411-1413