УДК 669.725.3
ОЦЕНКА ТЕРМОДИНАМИКИ И
КИНЕТИКИ ВЗАИМОДЕЙСТВИЯ ФЕНАКИТА С СЕРНОЙ КИСЛОТОЙ
1 Самойлов В.И., 2 Куленова Н.А ., 2 Серая Н.В.
1 – АО ”Ульбинский металлургический
завод”, 2 “Восточно-Казахстанский
государственный технический
университет им. Д. Серикбаева”
(г. Усть-Каменогорск)
Перспективность непосредственного вскрытия силикатного сырья серной кислотой в гидрометаллургии бериллия заключается в отсутствии затрат на активацию сырья [1], составляющих 20÷25% от суммарных затрат в гидрометаллургии. Энергия кристаллической решетки берилла, фенакита, бертрандита на 1 атом кислорода соответственно составляет, ккал/моль: 1433,2; 1331,62; 1162,76 [2]. Эти данные показывают, что химическая прочность указанных минералов увеличивается при переходе от бертрандита к фенакиту и далее к бериллу.
Экономическая целесообразность прямой сульфатизации того или иного минерала определяется его химической прочностью, зависящей от многих факторов. Непосредственное вскрытие бертрандита H2SO4 применяется на заводе фирмы “Браш Веллман” (США) и характеризуется высокой экономической эффективностью. В данной работе выполнена оценка термодинамики и кинетики процесса взаимодействия фенакита с H2SO4.
1 Термодинамика взаимодействия фенакита с серной кислотой
Предполагаемое взаимодействие фенакита с серной кислотой выражается уравнением реакции:
2BeO×SiO2
+ 2H2SO4 = 2BeSO4
+ SiO2
+ 2H2O (1).
Изменение энергии Гиббса реакции (1) DG0298(р-ции) связано с изменением энтальпии DH0298(р-ции) и энтропии DS0298(р-ции) данной реакции (при стандартных условиях – температуре Т, 0К) уравнением Гиббса-Гельмгольца:
DG0298(р-ции) = DH0298(р-ции) – DS0298(р-ции)٠T.
Для определения DH0298(р-ции) = SDH0298(прод.) – SDH0298(исх.) требуется найти
SDH0298(прод.) = 2٠DH0298(ВеSO4) + DH0298(SiO2) + 2٠DH0298(H2O)
и SDH0298(исх.)
= DH0298(2ВеO٠ SiO2) + 2٠DH0298(H2SO4).
При
расчете DS0298(р-ции) = SS0298(прод.) – SS0298(исх.)
необходимо определить SS0298(прод.) = 2٠S0298(ВеSO4)
+ S0298(SiO2) + 2٠S0298(H2O)
и SS0298(исх.)
= S0298(2ВеO٠ SiO2) + 2٠S0298(H2SO4).
По
стандартным значениям энтальпии образования DH0298 и энтропии S0298
исходных веществ и
продуктов реакции (1)
(табл. 1) рассчитаны изменения
Таблица 1 – Стандартные энтальпии образования DH0298 и энтропии S0298 при 2980К (250С)
|
Исходные вещества и продукты реакции (1) |
DH0298, кДж / моль |
S0298, Дж / моль . 0К |
Литературный источник |
|
2BeO×SiO2 (т) |
–2142,67 |
64,25 |
[3] |
|
H2SO4 (ж) |
–814,42 |
157,458 |
[4] |
|
BeSO4 (т) |
–1201,2 |
90,3 |
[4] |
|
SiO2 (т) |
–862,68 |
42,0 |
[4] |
|
H2O (ж) |
–286,93 |
70,207 |
[4] |
энергии Гиббса (DG0298(р-ции)), энергии системы (DH0298(р-ции)) и беспорядка в ней (DS0298(р-ции)), составившие DH0298(р-ции) = – 77,23 кДж/моль, DS0298(р-ции) = – 16,156 Дж/моль٠0К, DG0298(р-ции) = – 72,4 кДж/моль.
Из результатов
данного расчета следует, что реакция (1) не только термодинамически
вероятна, но и необратима, т.к. DG0298(р-ции) < –40 кДж/моль
[5].
Для определения термодинамической вероятности любого процесса можно также рассчитать DG0298(р-ции), пользуясь справочными величинами DG0298.
Суммарный
эффект влияния движущихся сил на реакцию (1), протекающую при постоянной
температуре и давлении, отражается изменением ее энергии Гиббса DG0298(р-ции):
DG0298(р-ции) = SDG0298(прод.) – SDG0298(исх.),
где SDG0298(прод.) = 2٠DG0298(ВеSO4) + DG0298(SiO2) + 2٠DG0298(H2O),
SDG 0298(исх.) = DG 0298(2ВеO٠ SiO2) + 2٠DG 0298(H2SO4).
По справочным материалам [3, 4] в данной работе определены:
SDG0298(прод.) = 2×(–1092,84)+ (–808,08) +2×(–238,098) = –3469,956 кДж/моль,
SDG0298(исх.) =
–2028 + 2×(–689,22) = –3406,44
кДж/моль,
DG0298(р-ции) = –3469,956 – (–3406,44) = –63,516 кДж/моль.
Полученное таким образом отрицательное значение DG0298(р-ции) также свидетельствует о необратимости протекания реакции (1) в прямом направлении при стандартной температуре.
2 Кинетика взаимодействия фенакита с серной кислотой
В данном разделе приведены
материалы работы КазИМО [6], направленной на
изучение кинетики взаимодействия фенакита с концентрированной H2SO4 и уточнен представленный в
отчете [6] расчет кинетики процесса.
Целью исследования [6] являлось определение степени извлечения Ве из фенакита в водорастворимый ВеSО4 при различных температурах и продолжительностях выщелачивания минерала.
Объектом исследований являлся фенакит крупностью -63 мкм, содержавший
41,2% масс. ВеО. Навески минерала массой 200 мг (82,4
мг по ВеО) обрабатывались 8 мл концентрированной
H2SO4 и
выдерживались при перемешивании полученной пульпы при заданных температурах
и продолжительностях выщелачивания. После окончания опыта пульпа
выщелачивания фильтровалась. Отфильтрованный осадок обрабатывался в стакане
горячей дистиллированной водой, отделялся от промывного раствора, сушился и
анализировался на содержание ВеО химическим
методом.
При определении влияния температуры процесса на степень извлечения Ве из фенакита в водорастворимый ВеSО4 получены данные,
приведенные в табл. 2.
Из данных табл. 2 следует, что при увеличении температуры процесса с 800С до 2600С извлечение Ве в раствор и скорость растворения ВеО возрастают в ~3 раза (соответственно с 19,0 до 57, 5% масс. и с 0,086 до 0,263 мг/мин).
В табл. 3 представлены результаты опытов, проводившихся аналогично предыдущей серии, но при различной продолжительности выщелачивания и температуре 2600С.
Из данных табл. 3 следует, что при увеличении продолжительности про-
Таблица 2 – Зависимость извлечения Ве в раствор от температуры выщелачивания (продолжительность выщелачивания – 3 ч)
|
Темпера-тура, 0С |
Остаток выщелачивания |
Извлечение Ве в раствор, % масс. |
Cкорость растворения ВеО, мг/мин |
|
|
Вес, мг |
Содержание ВеО, % масс. |
|||
|
80 |
159,1 |
42,01 |
19,0 |
0,087 |
|
160 |
177,0 |
33,10 |
28,9 |
0,132 |
|
220 |
178,7 |
27,18 |
40,8 |
0,187 |
|
260 |
194,5 |
18,00 |
57,5 |
0,264 |
Таблица 3 – Зависимость извлечения Ве в раствор от продолжительности выщелачивания
|
Продолжитель-ность, мин |
Остаток выщелачивания |
Извлечение Ве в раствор, % масс. |
Cкорость растворения ВеО, мг/мин |
|
|
Вес, мг |
Содержание ВеО, % масс. |
|||
|
15 |
168,8 |
36,60 |
24,80 |
1,362 |
|
167,4 |
37,28 |
24,20 |
1,329 |
|
|
30 |
154,0 |
30,00 |
44,70 |
1,228 |
|
150,0 |
38,54 |
29,10 |
0,799 |
|
|
60 |
146,5 |
29,82 |
47,00 |
0,645 |
|
151,1 |
27,01 |
50,00 |
0,687 |
|
|
180 |
194,5 |
18,00 |
57,50 |
0,263 |
|
300 |
184,0 |
12,25 |
72,60 |
0,199 |
|
144,5 |
9,00 |
84,20 |
0,231 |
|
цесса с 15 мин до 300 мин извлечение Ве в раствор возрастает более, чем в 3 раза (с 24,5 до 78,4 % масс.), а скорость растворения ВеО падает почти в 6,5 раз (с 1,345 до 0,215 мг/мин).
Далее в отчете [6] выполнена приблизительная оценка кинетики взаимодействия фенакита с H2SO4 и представлен соответствующий расчет с использованием уравнения Аррениуса:
Для этого авторами [6] выполнен соответствующий расчет (не представлен в отчете [6]) с использованием уравнения Аррениуса:
lgV = –Eкаж./4,574Т + С,
где V – скорость растворения ВеО из фенакита, моль/мин; Eкаж.– “кажущаяся” энергия активации реакции фенакита с H2SO4, кал/моль; Т – температура растворения, 0К; С – постоянная. Для проведения указанного выше расчета в отчете [6] составлена табл. 4 с использованием данных табл. 2.
В выводах работы [6] констатируется, что в интервале 80÷2600С рассчи- танная “кажущаяся” энергия активации реакции фенакита с H2SO4 составляет
Таблица 4 – Скорость взаимодействия фенакита с H2SO4
|
Температура |
1/Т, 0К-1 |
Скорость растворения ВеО из фенакита |
Значение lg V |
||
|
0С |
0К |
мг/мин |
моль/мин |
||
|
80 |
353 |
0,00283 |
0,087 |
0,00000348 |
-5,458 |
|
160 |
433 |
0,00231 |
0,132 |
0,00000548 |
-5,261 |
|
220 |
493 |
0,00203 |
0,187 |
0,00000748 |
-5,126 |
|
260 |
553 |
0,00187 |
0,264 |
0,00001050 |
-4,979 |
около 2250 кал/моль, а зависимость скорости указанной реакции от температуры выражается уравнением:
lgV = –500/Т – 4,08.
На основании приблизительной оценки кинетики взаимодействия фенакита с H2SO4, выполненной в отчете [6], его авторы делают вывод о том, что рассчитанные значения “кажущейся” энергии активации реакции фенакита с концентрированной H2SO4 при температуре 80÷2600С позволяют характеризовать ее как процесс, протекающий в диффузионной области.
Вместе с тем, уточненная оценка кинетики взаимодействия фенакита с H2SO4, выполненная нами, показала, что графическая зависимость lgV = f(Т) при более корректном подходе к оценке кинетики процесса должна иметь два перегиба и соответственно 3 участка: I-II, II-III и III-IV (рис. 1).
Нами рассчитаны величины Eкаж и С для участка I-II зависимости lgV = f(Т) (рис. 1) по данным табл. 4. При температуре реакции 80 и 1600С подстановка соответствующих численных значений из табл. 4 в уравнение Аррениуса дает 2 уравнения с двумя неизвестными: –5,458 = –0,00283Eкаж/ /4,574+С; –5,261 = –0,00231Eкаж/4,574+С. После совместного решения данных уравнений получаем Eкаж = 1970 кал/моль = 8,27 кДж/моль, С = –4,24.
Аналогичным образом рассчитаны и приведены в табл. 5 величины Eкаж и С для участков II-III и III-IV графической зависимости lgV = f(Т) (рис. 1).
Из данных табл. 5 следует, что на участках I-II, II-III, III-IV, судя по соответствующим величинам Eкаж
реакции, она протекает в диффузионной области, как об этом и был сделан
вывод в работе [6]. Однако, зависимость
lgV = f(Т) на участках I-II, II-III, III-IV заметно отличается от той, которая
выведена в отчете [6]. А именно, на участках I-II, II-III, III-IV
зависимость lgV = f(Т) по результатам нашего
анализа выражается следующими уравнениями:
–
на участке I-II уравнением lgV = 430,7/T – 4,24;
–
на участке II-III уравнением lgV = 500,2/T – 4,10;
– на участке III-IV уравнением lgV = 949,5/T – 3,20.
Данные кристаллооптического и
рентгеноструктурного анализа нерастворимых от выщелачивания кремнезема,
приведенные в отчете [6] показывают, что взаимодействие фенакита с
концентрированной H2SO4
тормозится выделением гидратированного
коллоидного кремнезема состава SiO2 . nН2О на поверхности зерен фенакита.
Появление пленки кремнезема на поверхности зерен фенакита, толщина которой
составляет ~10 мкм, затрудняет доступ растворителя к частицам фенакита.
![]()
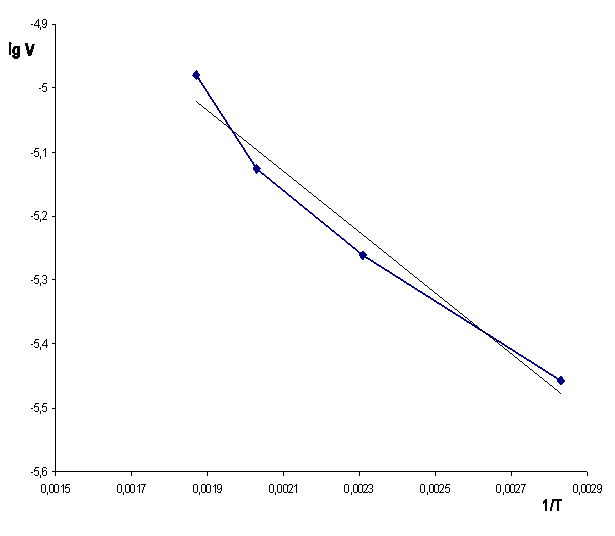
Рисунок 1 – Зависимость логарифма скорости реакции фенакита с серной кислотой от обратной температуры реакции
Таблица 5 – Расчет кинетики взаимодействия фенакита с концентрированной H2SO4 при температуре 80÷2600С
|
Участок зависимости lgV = f(Т) по рис. 1 |
Значение Eкаж реакции |
Постоянная С |
|
|
кал/моль |
кДж/моль |
||
|
I-II |
1970,0 |
8,3 |
–4,240 |
|
II-III |
2288,1 |
9,6 |
–4,100 |
|
III-IV |
4342,9 |
18,2 |
–3,199 |
Примечание. Значения “кажущейся” энергии активации реакций для кинетических, переходных и диффузионных процессов составляют соответственно 40÷300 кДж/моль, 20÷40 кДж/моль, 8÷20 кДж/моль [5].
Вывод.
Исследована термодинамика и кинетика взаимодействия
фенакита с серной кислотой и созданы предпосылки для разработки промышленных
методов непосредственного сернокислотного вскрытия данного минерала.