Киян В.С., Сарбасов Д.Д.*,
Берсимбаев Р.И.
Евразийский
национальный университет им. Л.Н. Гумилева, Казахстан
* Онкологический центр
им. М.Д. Андерсон, Техасский университет, США
Изучение белкового состава
ядерной мембраны и определение mTOR зависимых белков
mTOR
киназа регулирует трансляцию многих белков, которые связаны с ростом клетки и
ее размножением. Сверхактивация mTOR приводит к бесконтрольному делению
клеток и превращению их в раковые. mTOR фосфорилирует в основном
белки, которые участвуют в регуляции трансляции и определяет, какие процессы в
дальнейшем будут происходить в клетках [1].
mTOR образует две консервативные, структурно-различные
киназные комплексы – TORC1 и TORC2. Каждый комплекс фосфорилирует разный набор субстратов для
регулирования роста клеток. У млекопитающих активность mTOR стимулируется
действием факторов роста и высоким уровнем питательных веществ, а ингибируется
стрессами различного генеза (оксидативный стресс, глюкозное и аминокислотное
голодание). Исследования, проведенные с использованием культуры клеток разных
организмов, выявили локализацию mTOR в нескольких различных субклеточных
компонентах [2].
Недавние
исследования привели к открытию нового mTOR – комплекса, который регулирует ядерный импорт рибосомальных
белков и ассоциируется с ядерным поровым комплексом [3]. При воздействии на клетки аминокислотного голодания и
ингибиторов mTOR происходит снижение содержания
рибосомальных белков в ядерной, но не цитоплазматической фракции. Это говорит о
том, что импорт питательных веществ и рибосомальных белков в ядро клетки
зависят от ядерного mTOR комплекса.
Целью данной работы являлось изучение
белкового состава ядерной оболочки клетки и определение mTOR – зависимых белков.
Материалы
и методы. В
качестве объекта исследования нами использовались раковые клетки линии MDA-MB-435.
Для культивирования клеток использовали питательную
среду DMEM/Ham’s (1:1) с добавлением 10% фетальной сыворотки плода коровы,
пенициллина и стрептомицина в концентрации 100 мг/мл и 2 мМ L-глютамина. Для
подавления физиологических функций в клетках использовали среду RPMI 1640 без
аминокислот («USBioLab», США) и ингибитор связывания mTOR с АТФ –
РР242. В качестве лизирующего буфера использовали раствор А – содержащий 40 мМ
HEPES, 150 мМ KCl, 1mM MgCl2и В –содержащий 40 мМ HEPES, 150 мМ KCl,
2.5 мМ EGTA, 0.5% NP-40, 0.5% глицерол, 10 мМ β-глицерофосфат.
Вертикальный электрофорез проводили в градиентном полиакриламидном геле
по методу J. Laemmli et al. [4]. Для
разделения образцов нами использовались коммерческие градиентные гели 4-12% («Bio Rad», США). Перенос белков
осуществляли с помощью прибора для иммуноблотинга Owl VEP-2
(«Thermo Scientific»)
на PVDF мембрану («Millipore»,
США), детекцию белков производили с помощью
специфических и антивидовых антител («Santa Cruz», США). Реакцию проявляли химиолюминисцентным
субстратом,
который готовили непосредственно перед использованием путем смешивания двух
компонентов HRP Substrate Peroxide
Solution и HRP Substrate Luminol
Reagent в соотношении 1:1.
Приготовление градиента сахарозы и отбор
разделенных фракций проводили на градиентной станции
«Biocomp» (Gradient Station «Biocomp»). Разделение исследуемых образцов
осуществляли на высокоскоростной центрифуге Optima XL-100K («BECKMAN», США) с использованием ротора SV41 Ti. Окрашивание гелей
проводили с помощью набора Silver Quest
Staining Kit («Invitrogen», США).
Результаты масс-спектрофотометрии анализировали с
помощью программного обеспечения Scaffold
– 4.
Результаты
исследований. Клетки
линии MDA-MB-435 выращивались в питательной среде DMEM/Ham’s в течении 96 часов с
плотностью посадки 5 млн клеток на 1 мл среды. Далее клетки подвергали
воздействию ингибирующих агентов в течении 1 часа: среда RPMI-1640 без
аминокислот и РР242. Перед лизированием, клетки трижды промывали холодным
раствором 1хPBS. Для
отделения ядер клеток от цитоплазмы проводили лизирование буфером А, а затем
использовали буфер В для отделения ядерной мембраны. Полученные фракции ядерной
мембраны использовали для дальнейшего исследования, при котором проводили
разделение в градиенте сахарозы (0-50%) с использованием градиентной станции «Biocomp» (Gradient Station «Biocomp»).
Результаты разделения представлены на рисунке 1.
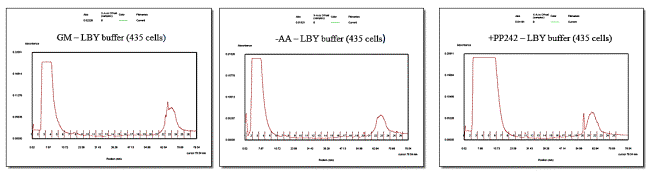
Рисунок
1 – Результаты разделения ядерной фракции в градиенте сахарозы (ось абсцисс –
оптическая плотность, ось ординат – номера фракций).
Как видно из рисунка
1, выделенная нами фракция содержит два комплекса веществ, выраженных на
графиках в виде двух пиков. При этом следует отметить, что при воздействии
ингибиторов количественное содержание белковых компонентов во фракциях
меняется: при аминокислотном голодании значительно уменьшается второй пик, а
при воздействии ингибитора РР242 увеличиваются оба пика, что говорит об
изменении содержания белковых комплексов в ядерной мембране и количества
ядерных белков.
Далее нами проведен
биохимический анализ полученных фракций методом разделения в градиентном
полиакриламидном геле и иммуноблотинга.
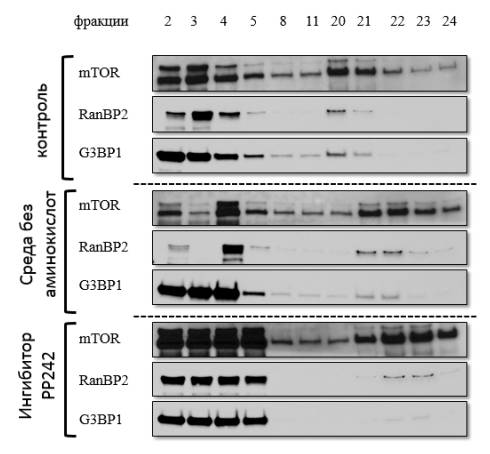
Рисунок 2 – Результаты
иммуноблотинга ядерных фракций
Данные иммуноблотинга показывают
значительные количественные изменения содержания белков, локализующихся на
ядерной мембране в изучаемых фракциях. Увеличение состава мембранных белков
ядра происходит при использовании ингибиторов mTOR в сравнении с контрольным образцом. Использование ингибитора
РР242 показывает значительное увеличение количества ядерных белков в двух
фракциях, что говорит о важном значении mTOR в процессе транспорта веществ из цитоплазмы в ядро и вовлечение
его в другие процессы, происходящие в ядре.
Для более детального исследования mTOR зависимых белков, нами проведен
масс-спектрофотометрический анализ полученной фракции ядерной мембраны клетки.
При этом исследованию подвергались три образца: контрольный – клетки выращенные
при нормальных условиях и два опытных образца, где клетки подвергались
воздействию аминокислотного голодания и ингибитора РР242.
Масс-спектрофотометрический анализ проводился в Whitehead Institute for Biomedical Research, Кембридж, штат Массачусетс, США.
В результате проведенного сравнительного анализа
исследуемых образцов было определено, что в состав полученной нами фракции во
всех образцах входило 290 белков. Более детальный анализ данных позволил
выделить группу белков – возможных белковых партнеров mTOR, к которым относятся белки группы Ran: RanBP2, RanBP1, RanGAP1, Ran, белки участвующие в транспорте веществ, к
которым относятся белки группы Importin. Кроме
этого значительные изменения показывают рибосомальные белки при использовании
ингибиторов mTOR.
Таким образом, проведенные нами
исследования показали, что ядерная мембрана клетки состоит из двух крупных
белковых комплексов, включает в себя 290 белков. Использование ингибиторов mTOR при выращивании клеточной культуры MDA-MB-435
приводит к количественным колебаниям белков в ядерной мембране, что указывает
на участие mTOR в процессе импорта веществ в ядро
клетки.
Литература:
1. Hsieh A.C., Yi
Liu, Edlind M.P. et al. The translational landscape of mTOR signaling steers cancer initiation
and metastasis // Nature. – 2012. – Vol. 485. – P. 55–61.
2. Betz C., Hall M.N. Where is mTOR
and what is it doing there? // Cell Biology. – 2013. – Vol. 4. – P. 563-574.
3. Shaiken T.,
Kazyken D., Kaz Y., Chen C.-H., Sarbassov D. Defining the nuclear role of mTOR
signaling. // Cold Spring Harbor Lab Meetinges. Dynamic Organization, New-York.
– 2012.
4. Laemmli V.K.
Cleavage of structural protection during the assembly of the head of
bacteriophage T 4 // Nature. – 1970. – Vol. 27. – P. 680-685.