Киян В.С., Сарбасов Д.Д.*, Берсимбаев Р.И.
Евразийский национальный университет им.
Л.Н. Гумилева, Казахстан
* Онкологический центр им. М.Д. Андерсон,
Техасский университет, США
Изучение взаимодействия
рекомбинантных форм белков Importin β1 и mTOR
mTOR является высоко консервативной серин-треонин киназой, которая участвует в регуляции уровня
питательных веществ внутри клетки и
митогенетических сигналах, а также
непосредственно изменяет анаболические эффекторные белки. mTOR
состоит из двух различных макромолекулярных белковых комплексов. mTOR
комплекс 1 (mTORC1)
фосфорилирует промежуточные
сигналы (р70S6 киназа и eIF4E-связывающий белок 1), участвующие в синтезе белка, росте клеток и клеточной пролиферации. TORC1
содержит адаптерный белок Raptor и мощно
подавляется рапамицином [1-3]. mTORC2 содержит адаптерный белок Rictor, устойчив к эффектам
рапамицина и контролирует цитокинез и выживание
клеток [4]. К стрессовым состояниям
клетки, которое снижает деятельность
mTORC1, относится голодание питательных веществ, инициирующее катаболические реакции, направленные на переработку энергетических субстратов (аутофагия) или уменьшение энергоемких процессов (оксидативное фосфорилирование и рибосомный
биогенез) [5]. У дрожжей регуляция транскрипции генов является важным компонентом клеточного ответа на
физической или питательный стресс [6]. Если рассматривать механизм, который требует TOR-связанные
фосфотазные субъединицы Tap42 и Pph1, то
снижение активности TOR приводит к увеличению в ядре содержания
стрессовых транскрипционных факторов
Gln3 или MSN2/4.
Ядерный импорт Gln3
требует участия кариоферина SRP1 [7]. У млекопитающих гомологами Tap42 и Pph1
являются α4 и PP2Ac, а SRP1 является кариоферином-α1 (KPNA1, импортин-α5). В клетках млекопитающих кариоферины семейства
α содержат шесть различных изоформ, каждая из которых действует как
адаптер для импортин-β опосредованного ядерного импорта другого
подсемейства импортируемых белков [8].
Цель данной работы изучить
взаимодействие рекомбинантных форм белков Importin β1 и mTOR,
а также возможное участие mTOR в импорте ядерных
белков.
Материалы
и методы.
Трансфекцию клеточной линии 293Т
проводили на 6 см чашках в количестве 2×105 на 1 мл
питательной среды путем культивирования в течение 24 часов. Количество
трансформированной ДНК составляло 0,5-1,0 мг на 1 чашку. При образовании
комплексов ДНК и липофектамина-2000 использовали соотношение 1:3.
Культивирование клеток проводили в течение 6 часов, затем вносили стандартную
ростовую среду с содержанием 10% фетальной сывороткой плода коровы и
антибиотиками. Клетки выращивали в течение 24-48 часов при 37°С и 5%
содержанием СО2. Электрофорез проводили в градиентном
полиакриламидном геле в присутствии додецилсульфата натрия по методу J. Laemmli
et al. [9] на аппарате для вертикального электрофореза. Для разделения образцов
нами использовались коммерческие градиентные гели 4-12% (фирма «BioRad», США).
Перенос белков из электрофорезного геля на нитроцеллюлозную мембрану
осуществляли с помощью прибора для иммуноблотинга Owl VEP-2
(фирма «Thermo Scientific», США) по H. Towbin
et al. Проявление изучаемых белков на мембране
проводили с использованием специфических антител (фирма «Santa
Cruz», США). Для лизирования клеток использовали буфер,
состоящий из 10 мМ Трис-HCl, pH7.5, 2.5 мМ MgCl2, 1.5 мМ KCl, 0.5%
Тритон X-100, 0,2 М LiCl, 0.5% деоксихолата натрия (C24H39NaO4).
Перед началом лизирования, в буфер добавляли ингибитор протеаз.
Результаты
исследований.
Трансфекцию клеток проводили с использованием рекомбинантных белков, у которых
имелись специфические метки, позволяющие изолировать комплексы с данными
белками: myc-mTOR, flag-Importin
β1 и flag-Raptor. Белок flag-Raptor
использовали в качестве положительного контроля, так как этот белок входит в
состав mTORC1 и позволяет методом иммунопреципитации изолировать изучаемый
белок mTOR. Реакцию
иммунопреципитации проводили с использованием специфических антител flag
(фирма «Santa Cruz», США). Полученные
данные представлены на рисунке 1.
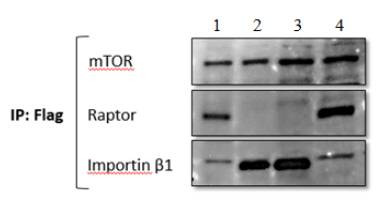
Рисунок 1 – Результаты иммуноблотинга взаимодействия
рекомбинантных форм белков Importin β1 и mTOR
(Примечание: 1 - myc-mTOR+ flag-Raptor,
2 - myc-mTOR +flag-Importin
β1, 3 – flag-Importin β1, 4 – flag-Raptor).
Из рисунка 1 видно, что белок mTOR
взаимодействует с белком Raptor, который входит в
состав mTORC1 и является консервативным компонентом данного комплекса. Кроме
этого, видна четкая связь рекомбинантных форм mTOR и Importin
β1, что говорит о возможном участии mTOR в ядерном импорте
веществ.
К основным белкам, участвующим в
импорте рибосомальных белков в ядро клетки, относится Importin β1. Так как нами
установлена связь данного белка с mTOR, то в дальнейшем была
проведена работа по изучению влияния mTOR на ядерный импорт
рибосомальных белков. Для этого были использованы условия, влияющие на работу mTOR
комплекса: аминокислотное голодание, ингибиторы РР242, Torin, Rapamycin
и LY. В эксперименте использовалась клеточная линия MDA-MB-435.
Воздействие ингибиторов и аминокислотного голодания проводили в течение 1 часа
перед началом лизирования клеток. Анализу подвергались рибосомальные белки RPL5 и RPL26
(рисунок 2).
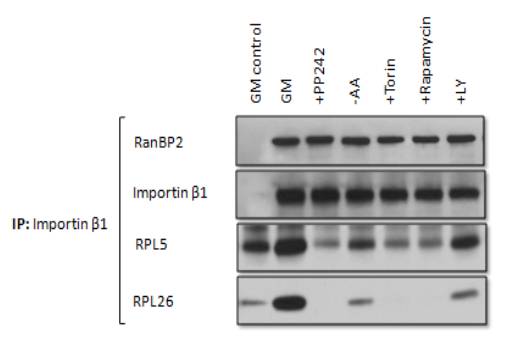
Рисунок 2 – Результаты использования ингибиторов mTOR
Данные представленные на рисунке 2
показывают, что использование ингибиторов mTOR напрямую влияет на
импорт рибосомальных белков, при которых отсутствует связывание Importin
β1 с рибосомальными белками RPL5 и RPL26. Использование стандартных условий без
использования ингибиторов показывает значительную связь этих белков.
Таким образом, проведенные нами
исследования указывают на наличие взаимосвязи между двумя белками – mTOR
и Importin β1. Установление данной связи позволило
показать непосредственное участие mTOR, посредством
использования ингибиторов данного белка, в ядерном импорте рибосомальных
белков.
Литература:
1. Hara K., Maruki
Y., Long X., Yoshino
K., Oshiro N., Hidayat S., Tokunaga C., Avruch J. and
Yonezawa K. Raptor, a binding partner of target of rapamycin (TOR), mediates TOR action. // Cell. – 2002. – Vol.
110. – P. 177–189.
2. Kim D. H.,
Sarbassov D. D., Ali S. M., King J. E., Latek R. R., Erdjument-Bromage H.,
Tempst P. and Sabatini D. M. mTOR interacts with raptor to form a
nutrient-sensitive complex that signals to the cell growth machinery. // Cell.
– 2002. – Vol. 110. – P. 163–175.
3. Sarbassov D.
D., Ali S. M. and Sabatini D. M. Growing roles for the mTOR pathway. // Cell
Biol. – 2005. – Vol. 17. – P. 596–603.
4. Sarbassov D.
D., Ali S. M., Kim D. H., Guertin D. A., Latek R. R., Erdjument-Bromage H.,
Tempst P. and Sabatini, D. M. Rictor, a novel binding partner of mTOR, defines
a rapamycin-insensitive and raptor-independent pathway that regulates the
cytoskeleton. // Curr. Biol. – 2004. – Vol. 14. – P. 1296–1302.
5. Zoncu R.,
Efeyan A. and Sabatini D. M. mTOR. From growth signal integration to cancer,
diabetes and ageing. // Nat. Rev. Mol. Cell Biol. – 2011. – Vol. 12. – P.
21–35.
6. De Virgilio C.
and Loewith R. Cell growth control. Little eukaryotes make big contributions.
// Oncogene. – 2006. – Vol. 25. – P. 6392–6415.
7. Carvalho J.,
Bertram P. G., Wente S. R. and Zheng, X. F. Phosphorylation regulates the
interaction between Gln3p and the nuclear import factor Srp1p. // J. Biol.
Chem. – 2001. – Vol. 276. – P. 25359–25365.
8. Yasuhara N.,
Oka M. and Yoneda Y. The role of the nuclear transport system in cell
differentiation. // Cell Dev. Biol. – 2009. – Vol. 20. – P. 590–599
9.
Laemmli V.K. Cleavage of structural protection during the assembly of the head
of bacteriophage T 4 // Nature. – 1970. – Vol. 27. – P. 680-685.