Асп. Жуков
Д.Н., д.т.н. Дыкман А.С.,
к.х.н. Зиненков
А.В., д.х.н., проф. де Векки А.В.
«НПО
ЕВРОХИМ»,
ФГУП «НИИСК им. акад. С.В.
Лебедева», Россия
Катализ перегруппировки
удриса-хокка
в среде
фенола и ацетона
Вторая стадия крупнотоннажного процесса
совместного получения фенола и ацетона заключается в разложении гидропероксида
кумола (ГПК) под действием серной кислоты на фенол и ацетон (перегруппировка
Удриса-Хокка). Процесс проводится в эквимолярной смеси фенола и ацетона [1].
Известно [2], что каталитическая
активность серной кислоты в рассматриваемом процессе возрастает при увеличении
доли фенола в смеси фенол-ацетон. Опубликованы наши наблюдения [3], показавшие,
что предварительное смешение фенола с серной кислотой позволяет получить в
1,2–1,5 раза более активный катализатор разложения ГПК, чем H2SO4.
Исходя из того, что фенолы легко вступают
в реакцию сульфирования, можно предположить, что повышение активности
катализатора происходит за счет смены каталитически активной частицы. Для
проверки выдвинутой гипотезы мы синтезировали ряд индивидуальных орто- и пара-фенолсульфокислот, поскольку в условиях процесса происходит
образование обоих изомеров.
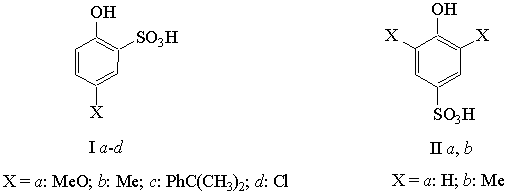
Изучение каталитической активности соединений
I(a–d) и II(a, b) проводилось
на пилотной установке, моделирующей заводской процесс разложения ГПК.
Постоянную скорость реакции поддерживали путем варьирования концентрации
кислоты в реакционной массе. В таблице приведены кинетические характеристики
процесса и относительная каталитическая активность изучаемых кислот.
Кинетические характеристики
каталитических свойств кислот
|
Кислота |
v×103,
л·моль‾1∙с‾1 |
СА×104, моль∙л‾1 |
|
|
I(a–d) |
~3,4 |
5,28 |
3,5 |
|
H2SO4 |
3,4 |
18,7 |
1,0 |
|
II(a, b) |
~3,5 |
43 |
0,43 |
Для установления причин более высокой каталитической
активности соединений I(a–d) нами была
измерена функция кислотности Гаммета (Н0)
(рисунок), характеризующая способность среды к переносу протона. Измерения проводились
в бинарных средах фенол-ацетон с разным содержанием ацетона. В качестве
эталонного соединения использовали хлорную кислоту, в качестве индикатора – 2-нитроанилин.
Полученные результаты позволяют сделать
следующие выводы. Хлорная кислота и соединения I(a–d) являются более сильными кислотами в среде фенол-ацетон
(группа кривых А), чем серная
кислота, причем их кислотные свойства не зависят от состава среды. Кислотность
серной кислоты зависит от состава среды и закономерно увеличивается при
возрастании концентрации фенола от 0,25 мольн. % (кривая С) до 0,44 мольн. % (кривая В).
Вероятно, такое различие в свойствах кислот связано с разными механизмами
стабилизации их анионов. Жесткий анион HSO4‾
хорошо сольватируется в средах с высоким содержанием фенола за счет
образования межмолекулярной Н-связи. Анионы кислот I(a–d) могут образовывать внутримолекулярную Н-связь, и поэтому
их стабильность меньше зависит от состава среды.
B A C
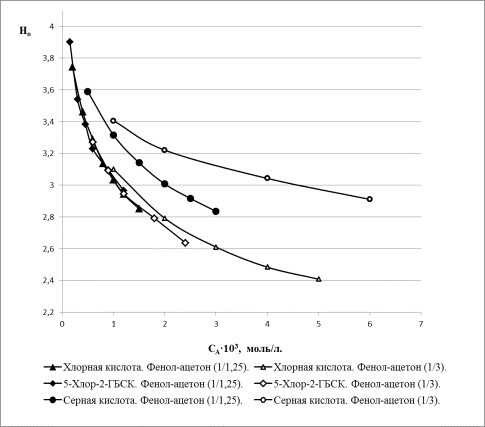
Зависимость функции кислотности хлорной, серной
и 5-хлор-2-гидроксибензолсульфокислоты (5-Хлор-2-ГБСК)
от их концентрации в средах с разным соотношением
фенол/ацетон
Таким образом, увеличение скорости
разложения ГПК происходит как за счет увеличения кислотности серной кислоты при
увеличении концентрации фенола, так и за счет его сульфирования при смешивании
с H2SO4 и смены каталитически активной частицы.
Литература
1. Кружалов Б.Д., Голованенко Б.И. Совместное
получение фенола и ацетона. – М.: Госхимиздат,
1963. 200 с.
2. Pat.
6057483 US. High Selective Method of Phenol and
Acetone Production / Zakoshansky V.M., Griaznov A.K., Vasilyeva I.I.; опубл. 02.05.2000.
3. Пат. 2330011 РФ. Способ получения
фенола и ацетона / Дыкман А.С., Зиненков А.В., Пинсон В.В., Гребенщиков
И.Н.; опубл. 27.07.2008, Бюл. № 21.