Жумабаева Д.C.1, д.х.н., проф.
Алдабергенов М.К.1,
D.Eng., проф. Бакенов Ж.Б.2
Казахский Национальный университет имени аль-Фараби,
Казахстан
Казахстанско-Британский технический университет, Казахстан
LiFeBO3 катодные материалы для литий-ионных батарей
С целью поиска новых материалов, которые могут быть
использованы в качестве катодных материалов для литиевых батарей, была
исследована система лития Li2O–FeO–B2O3. Такие исследования
были обусловлены растущим интересом к структурам, содержащим
катионы металла и полианионы. Однако полианионы являются неактивной частью массы в составе материала, что
препятствует увеличению удельной емкости на единицу массы. Обзор исследований
по этой теме показал, что большинство исследований включают тетраэдры групп (XO) с X=Mo, W, S, P или V [1]. Недавние
исследования показали перспективность более легкой группы ВО3 [1, 2]. FeBO3 (1,6 В
относительно Li°/Li+) был предложен как
анод, и LiFeBO3 (2,9 В) использовался как катод [1]. Исследования
показали, что емкость у LiFeBO3
даже на первом цикле меньше на 5% от теоретического (220 мА/г). LiFeBO3
кристаллизуется, образуя моноклинную систему C2/c [2-5].
Одной из положительных сторон LiMBO3 является стабильность
материала, что позволяет создавать аккумуляторные батареи, выдерживающие
гораздо больше циклов разрядки/зарядки, нежели современные аккумуляторы.
Благодаря стабильности этих электродов, существенно сокращаются
расходы на замену аккумуляторов. Другим существенным преимуществом LiMBO3, электродов
является их стабильность в экстремальных условиях, в частности, при воздействии
высокой температуры [6]. Структура материалов способна легко выдержать нагрев
до 3000С. Следует отметить, что другие катодные материалы в таких
условиях начинают разрушаться, что приводит к деградации батарей и даже к их
взрыву.
Нами был синтезирован и исследован
борат лития-железа в качестве катодного материала для литий-ионных
батарей. Образцы были получены золь-гель
методом [3, 4]. В
качестве исходных материалов использовались
борная кислота, нитраты
железа (II) и лития. Все использованные
реактивы имели марки «хч» или «осч». Все эксперименты проводили со свежеприготовленными растворами. Водный раствор стехиометрических соотношений реагентов
нейтрализовался добавлением 0.25 M раствора аммиака. Полученный гель сушился
сначала при 60oC в вакуумной
печи около 5 часов и далее прокаливвался при 6000С
24 часа в
инертной атмосферe
(смесь Н2+N2) для предотвращения образования
трехвалентного железа. Для улучшения проводимости
электрода из полученного LiFeBO3 был получен углеродный композит путем смешивания
материала с ацетиленовой сажей ( ацетилен черный) в шаровой мельнице. Углерод
обеспечивает электронную проводимость, не блокируя пути диффузии литиевых
ионов. Оптимальное количество углерода, зависит от микроструктуры и
эксплуатационных режимов катода и обычно находится в пределах 2–10 масс.%.
Для синтезированных соединений был проведен рентгенофазовый
анализа, который показал образование чистой фазы LiFeBO3 (Рис.1).
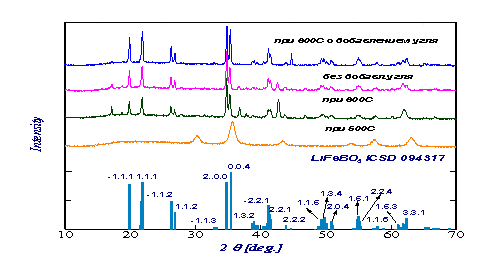
Рис.1
Рентгенофазовый анализ порошков LiFeBO3.
Детальное
исследование показало, что добавление углерода не влияет на фазовый состав и
структуру. Изучение состава и структуры нанокомпозитов установило, что стехиометрия полученных
материалов хорошо соответствует ожидаемому составу. Результаты
электронно-микроскопического исследования полученных материалов показывает, что полученные материалы имеют размерность частиц менее 1 μм (рис.2).


Рис.
2. Микрофотографии углеродных композитов LiFeBO3/C.
Для изучения электрохимического
отклика системы были получены циклические вольтамограммы литиевой
батареи с композитным электродом на основе LiFeBO3.
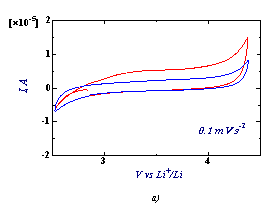
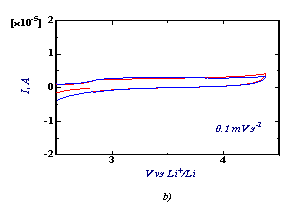
Рис.3.
СV LiFeBO3 при комнатной температуре, при 0,1 mV s-1 : а) с добавлением С, b) без
добавления С
Исследования
показывают, что LiFeBO3 является
перспективным катодным материалом для литий-ионных батарей. Получение данного
материала позволит значительно снизить стоимость литиевых батарей, а также
увеличить стабильность и продолжительность их работы.
Литература
1.
A.I. Palos, M, Morcette and P.
Strobel J. Solid State Electrochem. (2002), 6, 134-138.
2.
V. Legagneur, Y. An, A. Mosbah, R.
Portal, A.Le Gal La Salle, A. Verbaere, D. Guyomard andY. Piffard, Solid
State Ionics, (2001), 139, 37-46.
3.
M.Gaberscek, R.Dominko, M.Bele,
M.Remskar, D.Hanzel, J.Jamnik, Solid State Ionics (2005) 176, 1801-1805.
4.
S.B.Lee, I.C.Jang, H.H.Lim,
V.Aravindan, H.S.Kim, Y.S.Lee, J.of Alloys and Compounds (2010) 491, 668-672.
5.
V. Legagneur, Y. An, A. Mosbah, R.
Portal, A. Le Gal La Salle, A. Verbaere,D. Guyomard*, Y. Piffard, Solid State
Ionics(2001) 139, 37–46.
6.
M.K.Aldabergenov, G.T.Balakaeva,
A.B.Bayeshov, D.S.Zhumabayeva,
Electrochemical synthesis compounds of copper and iron in lowest
valency, Mendeleev congress on general and applied chemistry. M, 2007, V.1,
88-90.