Химия
и химические технологии/1. Пластмассы, полимерные и
синтетические материалы
Сейлханова Г.А., Оспанова А.К., Ашимхан Н.С.
Казахский национальный университет имени аль-Фараби, Казахстан
Анализ устойчивости комплексов ионов
Ве2+, Mg2+, Ca2+, Sr2+, Ba2+ с полиэтиленимином
Макромолекулярные
лиганды, как известно [1, 2], представляют более
эффективно связывающие ионы металлов реагенты, по сравнению с
низкомолекулярными соединениями. При этом для их широкого применения в
производстве необходима более полная информация о процессе их комплексообразования с ионами металлов: о
составе, устойчивости образующихся полимерметаллических координационных
соединениях, о влиянии различных
внешних факторов на их прочность и эффективность связывания низкомолекулярных
объектов.
С целью установления
составов и термодинамических констант устойчивости образующихся координационных
соединений был использован модифицированный метод Бьеррума [3]. Эксперименты проведены в интервале температур 298 -318 К и при нескольких значениях ионной силы раствора: 0,1;
0,5; 0,75; 1,0 (в качестве индифферентного электролита использован NaCl).
На рисунке 1
представлены кривые потенциометрического титрования полиэтиленимина кислотой в
отсутствии и присутствии ионов Ве2+, Мg2+, Са2+, Sr2+, Ва2+ соответственно при Т=298К, I=1,0 (кривые потенциометрического титрования, ПЭИ при
других значениях температуры и ионной силы раствора имеют аналогичный вид).
Кривые титрования в присутствие ионов металла - комплексообразователя находятся
в более кислой области, что подтверждает образование полиэтилениминовых комплексов с выделением протонов.
В системе ПЭИ-Be2+ наблюдается наибольший сдвиг кривой
титрования относительно чистого лиганда, что соответствует образованию более
прочного координационного соединения, на это указывают и данные расчетов
констант устойчивости полимерметаллических комплексов (ПМК).
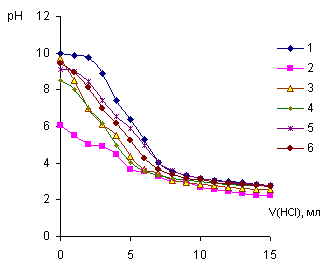
Рисунок 1 - Кривые
потенциометрического титрования ПЭИ(1) и систем
ПЭИ - М (М= Be(II)(2), Mg(II)(3),
Ca(II)(4), Sr(II)(5), Ba(II)(6))
В таблице 1 ( на
примере системы с участием ионов бериллия) приведены рассчитанные величины
функций образования Бьеррума (![]() )при
Т=298К, I=1,0. Ступенчатые константы
устойчивости найдены из кривых образования комплексов в системе координат
)при
Т=298К, I=1,0. Ступенчатые константы
устойчивости найдены из кривых образования комплексов в системе координат ![]() при половинных значениях
при половинных значениях ![]() .
.
Таблица
1 - Рассчитанные величины функций образования Бьеррума для системы ПЭИ – BeSO4 (k=0,5)
|
рН |
|
|
|
|
|
|
6,04 |
1,06·10-6 |
4,64·10-8 |
3,33·10-3 |
7,35 |
1,99 |
|
5,91 |
1,32·10-4 |
4,61·10-6 |
3,19·10-3 |
5,34 |
1,91 |
|
5,82 |
2,64·10-4 |
7,60·10-6 |
3,06·10-3 |
5,12 |
1,83 |
|
5,74 |
3,97·10-4 |
9,54·10-6 |
2,92·10-3 |
5,02 |
1,75 |
|
5,62 |
5,30·10-4 |
1,23·10-5 |
2,79·10-3 |
4,91 |
1,66 |
|
5,50 |
6,62·10-4 |
1,20·10-5 |
2,66·10-3 |
4,92 |
1,59 |
В таблице 2
представлены рассчитанные значения общих констант устойчивости
полиэтилениминовых комплексов ионов исследуемых металлов.
Прочность комплексов
определяется, прежде всего, как природой донорного атома лиганда, так и
природой иона металла-комплексообразователя.
Таблица
2 - Значения констант устойчивости полимерметаллических комплексов бериллия(II), магния(II), кальция(II) стронция(II) и
бария(II) с полиэтиленимином
|
Т, К |
I |
lg b |
||||
|
ПЭИ-Be2+ (k=0,5) |
ПЭИ-Mg2+ (k=0,5) |
ПЭИ-Ca2+ (k=0,5) |
ПЭИ-Sr2+ (k=0,5) |
ПЭИ-Вa2+ (k=0,5) |
||
|
298 |
0 |
10,16 ± 0,10 |
5,40 ± 0,05 |
5,91
± 0,06 |
5,89
± 0,06 |
5,86± 0,06 |
|
0,1 |
10,25 ± 0,09 |
5,80 ± 0,06 |
6,00
± 0,06 |
5,91
± 0,06 |
5,89± 0,06 |
|
|
0,5 |
10,85± 0,10 |
5,95 ± 0,06 |
6,90
± 0,07 |
5,95
± 0,06 |
5,90± 0,06 |
|
|
0,75 |
11,20± 0,11 |
6,70 ± 0,07 |
7,05 ±
0,07 |
5,97 ±
0,06 |
5,96± 0,07 |
|
|
1,0 |
11,40± 0,11 |
6,85 ± 0,07 |
7,30 ±
0,08 |
6,02 ±
0,07 |
6,00± 0,07 |
|
|
308 |
0 |
9,26±0,09 |
5,38 ± 0,05 |
5,86
± 0,06 |
5,83
± 0,06 |
5,81± 0,06 |
|
0,1 |
9,40±0,09 |
5,75 ± 0,06 |
5,95
±0,06 |
5,84± 0,06 |
5,82± 0,06 |
|
|
0,5 |
9,65±0,10 |
5,90 ± 0,06 |
6,70
± 0,07 |
5,86
± 0,06 |
5,83± 0,07 |
|
|
0,75 |
9,91±0,10 |
6,25 ± 0,06 |
6,75
± 0,07 |
5,88
± 0,06 |
5,86± 0,07 |
|
|
1,0 |
10,22±0,10 |
6,75 ± 0,07 |
6,80
± 0,07 |
5,90 ±
0,06 |
5,87± 0,08 |
|
|
318 |
0 |
7,85±0,08 |
4,69 ± 0,05 |
5,77 ±
0,06 |
5,57 ±
0,06 |
5,55± 0,08 |
|
0,1 |
7,88±0,08 |
5,70 ± 0,06 |
5,80 ±
0,06 |
5,60 ±0,06 |
5,58± 0,07 |
|
|
0,5 |
8,70±0,09 |
5,80 ± 0,06 |
5,82 ±0,06 |
5,70 ±0,07 |
5,68± 0,08 |
|
|
0,75 |
8,88±0,09 |
5,85 ± 0,06 |
5,90 ±
0,06 |
5,82 ±
0,07 |
5,81± 0,07 |
|
|
1,0 |
9,10±0,09 |
6,50 ± 0,07 |
6,40 ±
0,06 |
5,84 ±
0,07 |
5,82± 0,07 |
|
Известно, что ионы
щелочноземельных элементов относятся к ионам с электронной структурой инертного
газа [4]. Они являются относительно слабыми комплексообразующими ионами,
образующими соединения в основном за счет электростатического связывания. Ионы
этих металлов образуют комплексы с лигандами, содержащими в качестве донорных
центров атомы кислорода, азота. Устойчивость образуемых ими координационных
соединений тем больше, чем больше электронная плотность на ионе металла.
Устойчивость комплексов металлов, расположенных в одной группе периодической
системы, обычно изменяется в следующей последовательности: Ве2+ > Мg2+ > Са2+ > Sr2+ > Ва2+.
На основе анализа данных литературы и экспериментальных данных полученных в
работе, видно, что самым сильным комплексообразователем в указанном ряду
является ион Ве2+ благодаря его малому размеру и большой плотности
заряда, обладающего высокой поляризующей способностью, энергией гидратации,
проявляющего большую химическую активность, в частности в процессах
комплексообразования. При этом имеют место исключения, в частности устойчивость
их комплексов с этилендиаминтетрауксусной кислотой (ЭДТА) изменяется в ряду: Ве2+
>Са2+ > Sr2+>Ва2+≈Мg2+ [4, 5]. Это обстоятельство длительное время объяснялось
неполной реализацией дентатности ЭДТА и снижением эффективности взаимодействия
металл-донорные атомы лиганда вследствие увеличения соответствующих расстояний.
Однако результаты рентгеноструктурных исследований однозначно показали, что уменьшения
дентатности лиганда не происходит, а понижение устойчивости комплексов при
переходе от бериллия к магнию связано только со снижением эффективности
взаимодействия реагентов при сохранении максимальной дентатности ЭДТА.
Сравнительный анализ экспериментальных данных, представленных в таблице 2,
также указывает на меньшую прочность комплекса ПЭИ-Мg2+ при низких
значениях ионной силы раствора. Из литературы известно, что при образовании
комплексов ионов металлов с макромолекулярными лигандами необходимо учитывать и
их «структурное соответствие» друг другу [6]. Вероятно, при относительно неполной
нейтрализации заряда на полимере его гидродинамические размеры, структура
являются не благоприятными для комплексообразования с ионами магния, вследствие
чего, по аналогии с его комплексами с ЭДТА, также снижается эффективность
взаимодействия реагентов. При более
высокой ионной силе раствора и повышении температуры, как видно из таблицы
устойчивость полиэтилениминовых комплексов щелочноземельных элементов укладывается
в рамки классических представлений: Ве2+ > Мg2+ > Са2+ > Sr2+ > Ва2+.
Кроме того, согласно структурной теории электролитов О.Я. Самойлова ионы могут
перемещаться в растворе вместе с ближайшими молекулами воды или без них [7].
Для определения этого используют предложенный О.Я. Самойловым метод изучения
гидратации ионов в растворах. Трансляционное движение ионов и молекул воды в
растворах представляет собой активированные скачки. Ионы могут совершать их как
вместе с ближайшими молекулами воды, так и без этих молекул. В последнем случае
активированные скачки иона связаны с обменом ближайших молекул воды.
Исследование механизма самодиффузии в жидкостях и его особенностей у воды
позволило, используя экспериментальные данные, по подвижностям ионов и самодиффузии
в воде, оценить долю тех и других скачков в движении отдельных ионов.
Оказалось, что катион Мg2+ перемещается в
растворе только вместе с ближайшими молекулами воды, т.е. он относится к
положительно гидратирующимся ионам. Последние, как известно, укрепляют связь
молекул воды, составляющих ближайшее окружение иона, с молекулами второго
гидратного слоя, таким образом, упорядочивая структуру воды. Следовательно,
гидратированные ионы магния имеют большие размеры относительно ионов кальция,
стронция, бария, вероятно, это и способствует снижению эффективности их
взаимодействия с полимерным лигандом. Наличие определенной структуры воды
обусловлено образованием водородных связей, которые с повышением температуры
разрушаются, что, вероятно, приводит к снижению фактора их упорядоченности
вокруг ионов в растворе. Поэтому на основе также анализа экспериментальных
данных видно, что с ростом температуры устойчивость полиэтилениминовых
комплексов ионов щелочноземельных элементов уменьшается в ряду Ве2+>Мg2+>Са2+>Sr2+>Ва2+ в соответствии с
периодическим законом.
В соответствии с
принципом жестких и мягких кислот и оснований Пирсона (ПЖМКО) рассматриваемые
ионы металлов IIA группы являются жесткими кислотами, а функциональные
группы ПЭИ соответствуют жесткому основанию [8]. Согласно данному принципу в
результате жестко-жесткого взаимодействия образуются прочные хелатные
комплексы, в частности поэтилениминовые. Необходимо отметить, что указанный
принцип, предложенный Пирсоном на основе анализа процессов комплексообразования
ионов металлов с низкомолекулярными лигандами, как показали результаты
настоящей работы, согласуется с экспериментальными данными и в случае образования координационных соединений с
высокомолекулярными соединениями.
Анализ данных
таблицы 2 указывает на то, что устойчивость ПМК увеличивается с ростом ионной
силы. Это обусловлено тем, что присутствие неорганических электролитов
нейтрализует заряд на макромолекуле, что оказывает влияние на конформацию
полиэлектролитов, в результате увеличивается локальная концентрация
функциональных групп, вследствие чего усиливается координация в клубке
макромолекул. Кроме того, известно, что с увеличением в растворе мольной доли
соли концентрация свободной, не связанный с ионами соли воды уменьшается, в
результате чего становится меньше плотность гидратных оболочек,
непротонированных иминогрупп ПЭИ и катионов металла – комплексообразователя.
Все это способствует стабилизации полимерметаллических комплексов с ростом
ионной силы раствора.
Литература:
1
Бимендина Л.А.,
Яшкарова М.Г., Кудайбергенов С.Е., Бектуров Е.А. Полимерные комплексы. -
Семипалатинск, 2003. – 285 с.
2
Бектуров Е. А.,
Хамзамулина Р. Э., Бакауова З. Х. Молекулярные комплексы полимеров. – Алма-Ата:
Гылым, 1988. – 176 с.
3
Бьеррум Я. Образование
аминов металлов в водном растворе. - М.: Иностранная литература, 1961. – 274 с.
4
Дятлова Н.М., Темкина
В.Я., Попов К.И. Комплексоны и комплексонаты металлов. – М.: Химия, 1988. – 544
с.
5
Инцеди Я. Применение комплексов в аналитической химии. -
М.: Мир, 1979. - 376 с.
6
Спицын В.И.,
Мартыненко Л.И. Неорганическая химия. - М.: Изд-во МГУ, 1994. - 624 с.
7
Самойлов О.Я. Структура водных растворов электролитов и
гидратация ионов. - Москва, 1957. - 182 с.
8
Пирсон Р.Дж. Жесткие и мягкие кислоты и основания // Успехи
химии, 1971. Т.4, вып.7, С. 1259-1282.