Химия и химические технологии
/5.Фундаментальные проблемы создания новых материалов и технологий
К.х.н. Халиков
Р.М.
Уфимский
государственный университет экономики и сервиса, Россия
РЕГУЛЯЦИЯ АКТИВНОСТИ АМИЛОЛИТИЧЕСКИХ ФЕРМЕНТОВ НА СУПРАМОЛЕКУЛЯРНОМ
УРОВНЕ
Крахмалсодержащее сырье является
перспективным для производства технологических добавок в пищевой индустрии. Амилолитические
энзимы (гликозидазы или гликозид-гидролазы): α-амилаза, β-амилаза, глюкоамилаза и др. используются в метаболической
конверсии растительного сырья в пищевых технологиях [1]. Использование
ферментных препаратов в отраслях пищевой промышленности позволяет
интенсифицировать технологические процессы, улучшать качество и выход готовой
продукции и т.д.
Цель данной статьи – интерпретация супрамолекулярного
воздействия амилаз на субстраты и влияние различных факторов на энзиматическую
активность при гидролизе крахмалсодержащего сырья.
Полисахариды крахмала (амилоза и
амилопектин) расщепляются до олиго-, ди- и моносахаридов при одновременном
участии разнообразных амилолитических ферментов. Основная часть амилаз (лат. «amylum – крахмал») сухих семян и зернопродуктов находится в неактивном состоянии, а
активность энзимов не проявляется из-за отсутствия свободной воды, необходимой
для протекания биотехнологических реакций гидролиза.
Регуляция скорости ферментативного расщепления
макромолекул амилозы и амилопектина крахмального субстрата осуществляется: подготовкой
сырья – вида и состояния крахмала (нативный или клейстеризованный), выбором источника
выделения амилазных препаратов, а также мониторингом формирования
энзим+субстратных цитоструктур. Например, оптимальными условиями действия амилолитических
ферментов солода являются: рН 5,6–5,8
(влияние среды на формирование энзим+субстратного комплекса), температура
60–65°С и энзимы активируются ионами кальция и хлора, а ингибируются ионами
железа, хрома, меди.
Активный центр изоферментов α-амилаз представлен аминокислотными остатками аспарагиновой (Asp) и глютаминовой (Glu) кислот, а консервативные последовательности аргинина, гистидина и тирозина по всей вероятности участвуют в позиционировании субстрата в активном центре энзима (рис. 1). Третичная наноструктура амилаз формируется за счет самоорганизации доменов и приводит к усилению комплементарности [2] соответствия энзима+переходного состояния крахмального субстрата.
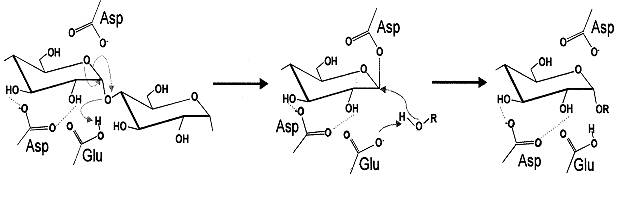
Рис. 1. Механизм расщепления полисахаридов крахмала при
участии амилаз
В супрамолекулярном механизме регуляции
каталитической активности различных амилаз на крахмальный субстрат имеются
отличия: α-амилаза гидролизует
крахмал внутри полиглюкановой цепи и в результате образуются декстрины,
мальтоза и α-глюкоза. При длительном гидролизе крахмала солодовой α-амилазой получают смесь углеводов,
состоящую в основном из α-мальтозы
и в незначительных количеств глюкозы. β-Амилаза отщепляет с конца макромолекул
дисахарид β-мальтозу, а фермент глюкоамилаза катализирует неспецифическое
отщепление остатков глюкозы; амило-1,6-глюкозидаза действует на «точки»
разветвления макромолекул амилопектина.
Регуляцию активности изоферментных α-амилаз можно осуществить за счет
изменений рН среды и концентраций
ионов кальция. Ионы Са2+
стабилизируют вторичную и
третичную структуру макромолекулы энзима и одновременно предохраняют фермент от
инактивирующего воздействия протеаз [3]. При рН 4,5 процесс инактивации α-амилаз в присутствии ионов кальция значительно замедляется
стабилизирующим воздействием ионов кальция на супрамолекулярном уровне
цитоструктур.
Несмотря на доминирующую роль
генетического фактора в биосинтезе ферментов (экстенсивный метод регуляции
активности), производительность биотехнологических процессов зависит и от
состава питательной среды. При этом важно не только наличие субстратов и
энзимов, но и биорегуляторов, играющих роль индукторов
или репрессоров биосинтеза
данного конкретного фермента. Механизм этого феномена еще не вполне изучен, но
сам факт должен учитываться при выборе технологии гидролиза нативного крахмала
[4]. Например, быстрое разрушение зерновой
α-амилазы при рН 3,3-4,0 дает возможность выпекать
ржаной хлеб из муки, которая содержит избыток α-амилаз при низких значениях рН,
чтобы предотвратить излишнее декстринирование крахмала в мякише хлеба.
Одним из механизмов регуляции скорости расщепления крахмальных гранул является система протеиновых ингибиторов амилаз, широко представленных у растений. Ингибиторы белковой природы избирательно взаимодействуют с амилазами и образуют неактивные комплексы "энзим + ингибитор". Например, высокой активностью обладают ингибиторы амилаз картофельного сока.
Для получения высокоактивных биотехнологических
препаратов амилаз используют грибы: Aspergillus oryzae, A. niger и A. wentii. В хлебопечении чаще используют
ферментные препараты грибов, в которых α-амилаза быстро инактивируется при
выпечке и этим предотвращается нежелательное накопление избытка декстринов. Замена
солода энзимными препаратами в спиртовых производствах увеличивает выход
целевого продукта.
Среди бактерий к активным продуцентам
амилаз относятся некоторые бациллы (Bacillus macerans, В. polymyxa, В.
subtilis) и др. Например, в работе [5] исследованы межчастичные
взаимодействия осахаривающих амилолитических ферментов в продуктах
культивирования нескольких штаммов В. subtilis по отношению к
крахмальному субстрату.
Амилолитические энзимы отличаются по своей
термостабильности: например, α-амилаза
более устойчива к воздействию высоких температур. В пищевых предприятиях
эффективно используются разнообразные амилазы, активность которых зависит от
температуры, рН среды, наличия ионов биогенных
металлов (активаторов или ингибиторов) и т.д. Получить хлеб с надлежащей
пористостью, объемом и окраской корки можно только в том случае, если на всех
стадиях технологического процесса достаточно сахаров, обеспечивающих интенсивность
газообразования.
Таким образом, активность ферментов, катализирующих
гидролиз макромолекул крахмал, можно регулировать на супрамолекулярном уровне разнообразными
технологическими методами.
Литература:
1.
Нечаев А.П., Траубенберг
С.Е., Кочеткова A.A. и др. Пищевая
химия. – СПб. : ГИОРД, 2012. - 668 с.
2.
Машуков Н., Халиков Р.,
Хараев А. Стабилизация и модификация молекулярных структур. – Saarbrucken:
Palmarium Academic Publishing, 2014. - 216 с.
3.
Van der Maarel M., van der Veen B., Uitdehaag J. et al. Properties and applications of starch-converting enzymes of the α-amylase family //
Journal of Biotechnology. 2002. V.94. N.2. P.137-155.
4.
Папахин А.А., Бородина
З.М., Лукин Н.Д. и др. Методика оценки действия
амилолитических ферментов на нативный крахмал // Хранение и переработка
сельхозсырья. 2014. № 4. С.14-17.
5.
Алеева С.В., Кокшаров С.А. Проявление межчастичных
взаимодействий амилолитических ферментов // Известия вузов. Химия и химическая
технология. 2004. Т. 47. №7. С.12-15.