Балыбин Дмитрий Викторович
ФГБОУ ВПО Тамбовский государственный университет им. Г.Р. Державина
Кудрявцева Наталия Михайловна
ФГБОУ ВПО Тамбовский государственный университет им. Г.Р. Державина
Попова Екатерина Дмитриевна
ФГБОУ ВПО Тамбовский государственный университет им. Г.Р. Державина
Шамсиева Екатерина
Аркадьевна
ФГБОУ ВПО Тамбовский государственный университет им. Г.Р. Державина
ВЛИЯНИЕ
ГУАНИДИНА (ГУ) НА КИНЕТИКУ АНОДНОГО РАСТВОРЕНИЯ ЖЕЛЕЗА В КИСЛЫХ ВОДНЫХ И
ВОДНО-ЭТИЛЕНГЛИКОЛЕВЫХ РАСТВОРАХ НС1
Введение
Анодная ионизация металлов имеет большое
значение в электрохимии. От характера этого процесса в значительной мере
зависят эксплуатационные характеристики гальванических элементов и
аккумуляторов, а также коррозионное поведение конструкционных металлических
материалов. В последние годы наиболее интенсивно изучается процесс анодного
растворения металлов подгруппы железа. Именно на примере изучения железа и
сформулированы многие количественные выводы, подтверждающие роль химического,
адсорбционно-химического и электрохимического взаимодействия в сложном процессе
ионизации металла. В данной работе исследуется связь кинетики анодного
растворения железа при различной кислотности и концентрации гуанидина в водных
и водно-этиленгликолевых кислых хлоридных растворах.
Методика
эксперимента
Изучена добавка гуанидин, бесцветное сильное
однокислотное гигроскопичное органическое основание с рКа протонированной
формы, иона гуанидиния, по одним данным равным в воде 13, 6 [1]; по другим – 11
[1]. Графическая формула гуанидина выглядит следующим образом
 .
.
Исследования проведены в водных и
водно-этиленгликолевых растворах с составом электролита хМ НСl + (1–х)М LiCl,
полученных насыщением исходных растворителей сухим хлористым водородом с
последующим разбавлением ими полученной системы до заданной кислотности и
введением высушенного при 107°С хлорида лития. Поляризационные измерения
проведены на неподвижном электроде в потенциодинамическом режиме с
использованием потенциостата IPC-PRO.
Потенциалы пересчитаны по стандартной водородной шкале. Поляризация
проведена от стационарного потенциала на 200 мВ в анодную область в
потенциодинамическом режиме (скорость развертки – 0,66 мВ/сек.). Рабочий
электрод с видимой поверхностью 0,5 см2 армировали в оправу из
эпоксидной смолы, отвержденной полиэтиленполиамином, перед экспериментом
шлифовали и полировали, затем обезжиривали ацетоном. Использована
трехэлектродная электрохимическая ячейка с разделенным шлифом анодным и
катодным пространствами, вспомогательный электрод платиновый.
Экспериментальные
результаты и их обсуждение
Во всех изученных растворах гуанидин
существенного влияния на процесс не оказывал, но в небольшой мере явился
стимулятором процесса, о чем свидетельствуют рассчитанные положительные порядки
реакции по ионам добавки (таблица 1, рис. 1, 2, 3) [2].
Таблица 1. Зависимость nГУ от состава электролита
хМ НС1 + (1-х)М LiC1
|
Среда |
СНС1, моль/л |
nГУ |
|
Вода |
0,1 |
0,11 |
|
10 масс. % воды в этиленгликоле |
0,99 |
0,14 |
|
этиленгликоль |
0,05 |
0,05 |
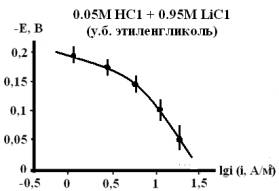
Рис. 1. Влияние гуанидина на
скорость анодного процесса растворения железа в кислых спиртовых хлоридных
растворах с составом электролита 0,05М НС1 + 0,95М LiC1, содержащих 0,5мМ,
1мМ, 5мМ и 10мМ гуанидина.
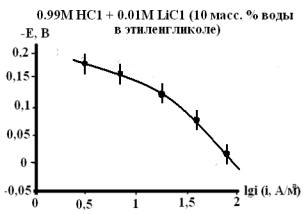
Рис. 2. Влияние гуанидина на скорость анодного процесса
растворения железа в кислых водно-спиртовых хлоридных растворах с составом
электролита 0,99М НС1 + 0,01М LiC1, содержащих 0,5мМ,
1мМ, 5мМ и 10мМ гуанидина.
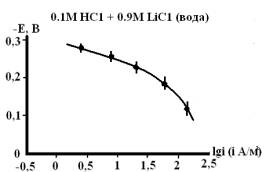
Рис. 3. Влияние гуанидина на
скорость анодного процесса растворения железа в кислых водных хлоридных
растворах с составом электролита 0,1М НС1 + 0,9М LiC1, содержащих 0,5мМ,
1мМ, 5мМ и 10мМ гуанидина [3].
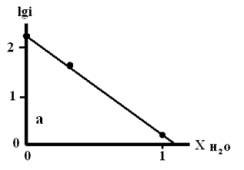
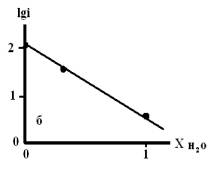
Рис. 4. Зависимость lgi
от мольной доли воды в смешанном растворителе c составом электролита
0.99М НС1 + 0.01М LiC1, содержащего: а) 10мМ ГУ;
б) 1мМ ГУ.
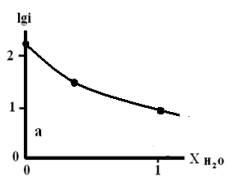
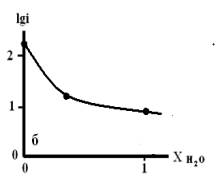
Рис. 5. Зависимость lgi
от мольной доли воды в смешанном растворителе c составом электролита
0.05М НС1 + 0.95М LiC1, содержащего: а) 10мМ Гу;
б) 1мМгу.
Из рисунков 4 и 5 следует, что с увеличением мольной доли
воды в смешанном растворители наблюдается уменьшение скорости процесса анодного
растворения металла.
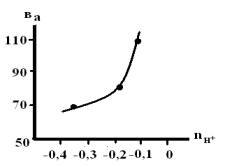
Рис. 6. Зависимость ва
от порядка реакции по ионам водорода в смешанном растворителе c
составом электролита хМ НС1 + (1-х)М LiC1, содержащего 1мМ ГУ.
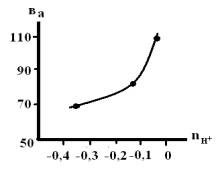
Рис. 7. Зависимость ва
от порядка реакции по ионам водорода в смешанном растворителе c
составом электролита хМ НС1 + (1-х)М LiC1, содержащего 10мМ ГУ.
Зависимости величины тафелевского угла наклона
от порядка реакции по ионам водорода на рисунках 6, 7 являются
характеристическими для рассматриваемого процесса и хорошо согласуются с ранее
полученными данными [3].
Скорость массопереноса водорода через
вертикально расположенную стальную мембрану толщиной 300 мкм и площадью 3,63 см2
(в состоянии поставки) определяли по методике в электрохимической двухкамерной
ячейке типа Деванатхана, изготовленной из стекла «Пирекс» в отсутствии
принудительной деаэрации. В поляризационную часть ячейки вводили рабочий
раствор, а в диффузионную – точно фиксированный объем титрованного 0,01 н
раствора KМnO4. Продолжительность единичного эксперимента составляла
2 часа, при комнатной температуре. Измерения проводились при потенциале
коррозии и анодной поляризации входной стороны мембраны.
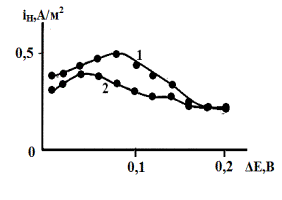
Рис. 8. Влияние анодной
поляризации на поток твердофазной диффузии через мембрану из условно безводных
этиленгликолевых растворов с составом электролита 0,99М HCl
+ 0,01М LiCl. 1 – фон; 2 – фон + 1 мМ гуанидина.
В фоновой среде в присутствии 0,99 моль/л ионов
водорода в форме С2Н4(ОН)2Н+ и
сольватации поверхности стали практически исключительно молекулами двухатомного
спирта функция iН = ¦(DEа) проходит через
максимум при DEа = 0,08 В (рис.8, кривая
1). При переходе к раствору содержащему 1 мМ гуанидина (рис.8, кривая 2) с той
же кислотностью максимум на зависимости iН = ¦(DEа) наблюдается при DEа = 0,04 В, но выражен он
более слабо, чем в фоновом растворе, вероятно, в силу, более малых абсолютных
значений iH. При снижении кислотности до 0,05 моль/л НС1,
общая тенденция сохраняется (рис.9). По-прежнему наблюдается максимум при DEа = 0,06 В на зависимости
iН = ¦(DEа) [4].
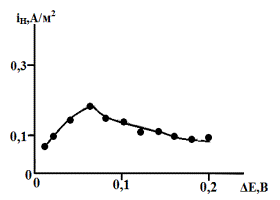
Рис. 9. Влияние анодной
поляризации на поток твердофазной диффузии через мембрану из условно безводных
этиленгликолевых растворов с составом электролита 0,05М HCl
+ 0,95М LiCl + 1мМ гуанидина.
Выводы:
1.
В
данных условиях гуанидин является активатором растворения железа, так как
порядки реакций, рассчитанные по частицам добавки, имеют
положительные значения.
2.
Сложный
характер зависимости имеют АПК в смешанном растворителе, поскольку при прочих
равных условиях одним из определяющих является фактор влияния природы
смешанного растворителя, обладающего индивидуальными физико-химическими
свойствами.
3.
С
увеличением мольной доли воды в смешанном растворителе, содержащем гуанидин,
происходит уменьшение скорости процесса.
4.
Зависимость
потока диффузии водорода через мембрану от величины анодной поляризации во всех
изученных составах проходит через максимум в области 0,04 £ DEа £ 0,08 В.
С уменьшением кислотности растворов абсолютная величина iH,max
снижается, но при этом качественно вид зависимости iH = f(DEа) не меняется.
Литература:
1.
Альберт
А., Сержент А.Е.. Константы ионизации кислот и оснований. // М.: Химия. 1964.
С. 179.
2.
Колотыркин
Я.М. Металл и коррозия. М.: Химия. 1981.
3.
Вигдорович
В.И., Цыганкова Л. Е. Электрохимическое и коррозионное поведение металлов в
кислых спиртовых и водно-спиртовых средах. Монография.- М.: Радиотехника, 2009.
С. 328.
4.
Балыбин
Д.В. Влияние гуанидина и фенилбигуанидина на кинетику реакции выделения водорода
на железе и его диффузию через стальную мембрану в этиленгликолевых растворах
НС1 // Диссертация. Тамбов. 2011.