Бутенко А.В.
Первый МГМУ им.И.М.Сеченова, г.Москва
студентка
Патогенез
когнитивных нарушений
при
гипергомоцистеинемии
Вследствие стремительного развития биохимии
становится возможным исследование влияний различных веществ не только на
метаболизм человека, но и на патогенез различных заболеваний. В данной статье
представлен краткий обзор литературы по вопросам токсичности гомоцистеина и
роли этого вещества в развитии когнитивных нарушений у человека.
Многие современные авторы указывают на то, что
пожилые люди с повышенным уровнем гомоцистеина в крови склонны к развитию
нейропсихических заболеваний, таких как болезнь Альцгеймера, болезнь
Паркинсона, шизофрения, деменция [2, 9, 11, 12, 13, 16]. Нарушения, возникающие
в данных случаях, как правило, затрагивают вербальную память, исполнительную
функцию и скорость психомоторных реакций. При патологоанатомическом
исследовании у пациентов с гипергомоцистеинемией нередко обнаруживают местную
атрофию головного мозга в области базальных ядер, лобной доли, медиальной части височной доли и гиппокампа.
Наличие подобных изменений объясняется цереброваскулярным тромбозом,
развивающимся под действием гомоцистеина, а также нейротоксическим эффектом,
который обусловлен поступлением потока кальция в клетки при
связывании гомоцистеина с NMDA-рецепторами [5, 14].
Gabryelewicz T. и соавторы обнаружили, что люди,
у которых умеренные когнитивные
нарушения перешли в деменцию, имеют
более высокий уровень гомоцистеина в крови относительно тех, у кого не наблюдалось ухудшения
состояния [9]. Более того, результаты некоторых
других исследований указывают на развитие деменции в течение 8-11 лет с
момента диагностирования гипергомоцистеинемии, а также раннее прогрессирование
заболевания [12, 13]. При уровне гомоцистеина в крови выше 14 ммоль/л риск
развития деменции увеличивается в два раза [13]. Это объясняется возникновением
церебральной микроангиопатии, эндотелиальной дисфункцией, снижением активности
оксида азота, интенсификацией окислительного стресса, что ускоряет процессы
старения головного мозга [13, 16].
Гипергомоцистеинемия способствует развитию
атеросклероза и ангиопатий, так как гомоцистеин интенсифицирует процессы
синтеза коллагена, пролиферации гладкомышечных клеток сосудов, увеличивает
уровень холестерина в крови через повышение активности ГМГ-КoA редуктазы –
фермента, участвующего в синтезе холестерина. Ganguly P. и Sreyoshi F. A.
(2015) указывают, что при повышенном уровне гомоцистеина в крови наблюдается
уменьшение количества эластических волокон и ухудшение их функциональных
свойств [10]. Ряд авторов говорят о создании условий для развития тромбозов при
гипергомоцистеинемии. Это происходит вследствие повышения адгезивных свойств
тромбоцитов к клеткам эндотелия и посредством увеличения уровня таких
протромботических факторов, как β-тромбоглобулин, активатор тканевого
плазминогена, фактор VIIc [7, 10, 16]. Помимо этого гомоцистеин способен
действовать как возбуждающий нейромедиатор, конкурируя с тормозными медиаторами, например с ГАМК
[3, 14]. Это приводит к уменьшению
активности ГАМКA и ГАМКВ рецепторов и далее к повышению
проницаемости микрососудов. В результате происходит разрушение межклеточного
матрикса гематоэнцефалического барьера, за чем может последовать развитие
сосудистой деменции [3].
В патогенезе атеросклероза при
гипергомоцистеинемии выделяют два основных фактора: повреждающее действие
окислительного стресса и нарушение синтеза NO.
Окислительный стресс рассматривается как
состояние, возникающее при чрезмерном накоплении активных форм кислорода,
пероксидов и их вторичных продуктов обмена [1]. Избыточное количество свободных
радикалов при гипергомоцистеинемии может возникать либо вследствие чрезмерного
стимулирования NADPH оксидазы, либо объясняться химической активностью
гомоцистеина (Рисунок 1). При патологических значениях pH в присутствии O2
гомоцистеин может инициировать реакции окисления с образованием дисульфидов
(RSSR), так как содержит активную сульфгидрильную группу (–SH) [1, 15].
2 RSH +
O2 → RSSR + O2 • – → H2O2
В результате происходит выделение большого
количества активных форм кислорода, включая супероксид-анион радикал (О2
• –) и перекись водорода (Н2О2) [15]. Супероксид анион,
образовавшийся под влиянием гомоцистеина, опосредованно нарушает активность NO
посредством ускорения реакций использования этого радикала для образования
пероксинитрита: NO+O2 = ONOO- [7].
В результате окислительного стресса происходит
повышение уровня окисленных форм ЛПНП (ox-ЛПНП), наличие которых
является риском развития атеросклероза [7, 16].
NO – простой свободный
радикал, который синтезируется из аргинина и присутствует во всех типах
кровеносных сосудов. В норме он участвует в процессе вазодилатации, так как
активирует гуанилатциклазу, которая в свою очередь увеличивает синтез цГМФ в
гладкомышечных клетках. NO обладает
противовоспалительной и антиокислительной функциями, предотвращает агрегацию
тромбоцитов, тем самым предупреждая развитие атеросклероза и тромбозов [6].
Было установлено, что гомоцистеин увеличивает
количество ассиметричного диметиларгинина, который является эндогенным
ингибитором NO-синтазы, а также
способствует окислению ко-фактора этого фермента – БП4, что нарушает
синтез NO (Рисунок 1) [6, 7].
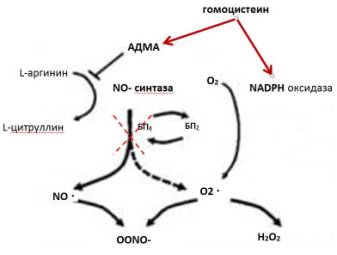
Рисунок
1. Влияние гомоцистеина на окислительный стресс и синтез NO.
АДМА – ассиметричный
диметиларгенин; БП4 –
тертрагидробиоптерин; БП2 – дигидробиоптерин.
Таким образом, гомоцистеин в избыточных
количествах способен оказывать повреждающее действие на нервные клетки как
напрямую, так и опосредованно через нарушение трофики нервной ткани, провоцируя
развитие атеросклероза и ангиопатий. Данные изменения влекут ухудшение функциональной
активности головного мозга, что проявляется в развитии деменции, болезни
Альцгеймера и других заболеваний, сопровождающихся снижением когнитивных
способностей.
Остается неясным, является ли
гипергомоцистеинемия самостоятельным фактором риска развития когнитивных
нарушений. Вероятно, снижение познавательных функций выступает следствием
дефицита витаминов группы В, нехватка
которых проявляется в поражении ЦНС [3]. Blasko I. и соавторы указывают, что
назначение фолата, пиридоксина и цианокобаламина оказывает благоприятное
действие на головной мозг, уменьшая проявления атрофии при повышенном уровне
гомоцистеина в крови, замедляет процесс развития слабоумия у пациентов с
болезнью Альцгеймера [4]. Однако в независимом клиническом исследовании,
проведенном Ford, не было зафиксировано улучшения состояния у пациентов с
болезнью Альцгеймера, которые осуществляли ежедневный прием 2 мг фолиевой
кислоты, 25 мг витамина В6 и 400 мг витамина В12 в течение 2 лет [8].
Литература:
1.
Аль-Акрас Рашад Кадим Махмуд. Влияние окислительного стресса
на уровень цитокинов в культуре клеток // МНИЖ . 2014. №4-1 (23). URL: http://cyberleninka.ru/article/n/vliyanie-okislitelnogo-stressa-na-uroven-tsitokinov-v-kulture-kletok (дата обращения: 21.01.2016).
2.
Alexopoulos P., Topalidis S.,
Irmisch G., Prehn K., Jung S.U., Poppe K. et al. Homocysteine and cognitive
function in geriatric depression. Neuropsychobiol. 2010; 61: 97-104.
3.
Ansari R., Mahta
A., Mallack
E., Luoa
J.J. Hyperhomocysteinemia and
Neurologic Disorders: a Review J Clin Neurol. 2014 Oct; 10(4):
281–288.Published online 2014 Oct 6. doi: 10.3988/jcn.2014.10.4.281 PMCID: PMC4198708.
4.
Blasko I., Hinterberger M., Kemmler
G., Jungwirth S., Krampla W., Leitha T. et al. Conversion from mild cognitive
impairment to dementia: influence of folic acid and vitamin B12 use in the VITA
cohort. J Nutr Health Aging 2012; 16:687-694.
5.
Chen C.S., Kuo Y.T., Tsai H. Y., Li
C.W., Lee C.C., Yen C.F. et al. (2011). Brain
biochemical correlates of the plasma homocysteine level: a proton magnetic
resonance spectroscopy study in the elderly subjects. Am. J. Geriatr.
Psychiatry 19, 618–626. doi: 10.1097/JGP.0b013e318209ddf1
6.
Crabtree M.J., Channon K.M.
Synthesis and recycling of tetrahydrobiopterin in endothelial function and
vascular disease. Nitric Oxide. 2011; 25(2):81-8.
7.
Eren E., Ellidag H. Y., Aydin O.,
Yilmaz N. Homocysteine, Paraoxonase-1 and Vascular Endothelial Dysfunction:
Omnibus viis Romam Pervenitur // Journal of Clinical and Diagnostic Research.
2014 Sep, Vol-8(9): CE01-CE04. Р. 1 – 4.
8.
Ford A.H., Flicker L., Alfonso H.,
Thomas J., Clarnette R., Martins R. et al. Vitamins B(12), B(6), and folic acid
for cognition in older men. Neurology 2010;75:1540-1547.
9.
Gabryelewicz T., Styczyńska M.,
Łuczywek E., Barczak A., Pfeffer A., Androsiuk W. et al. The rate of
conversion of mild cognitive impairment to dementia: predictive role of
depression. Int. J. Geriatr. Psychiatry 2007; 22: 563-567.
10.
Ganguly P., Sreyoshi F. A. Role of
homocysteine in the development of cardiovascular disease. Nutrition Journal
2015, 14:6.
11.
Moustafa A.A., Hewedi D.H., Eissa A.M., Frydecka D., Misiak B. Homocysteine levels in
schizophrenia and affective disorders-focus on cognition. Front Behav Neurosci. 2014 Oct 6;8:343. doi:
10.3389/fnbeh.2014.00343. eCollection 2014.
12.
Nurk E., Refsum H., Tell G.S.,
Engedal K., Vollset S.E., Ueland P.M. et al. Plasma total homocysteine and
memory in the elderly: the Hordaland homocysteine study. Ann Neurol. 2005
13.
Seshadri S., Beiser A., Selhub J., Jacques P.F., Rosenberg I.H., D'Agostino R.B., Wilson P.W., Wolf
P.A. Plasma homocysteine as a risk factor for
dementia and Alzheimer's disease. N Engl J Med. 2002
Feb 14; 346(7):476-83.
14.
Tyagi S.C., Lominadze D., Roberts
A.M. Homocysteine in microvascular endothelial cell barrier permeability. Cell
Biochem Biophys 2005; 43:37-44.
15.
Yilmaz N. Relationship between
paraoxonase and homocysteine: crossroads of oxidative diseases // Arch Med Sci
1, February / 2012. Р. 138 – 153.
16.
Zhang S., Yong-Yi B., Luo L.M., Xiao
W.K., Wu H.M., Ye P. Association between serum homocysteine and arterial
stiffness in elderly: a community-based study. J Geriatr
Cardiol. 2014; 11:32–8.