к.т.н. Питак И. В., д.т.н.
Шапорев В. П., к.т.н. Питак О. Я.
Национальный технический университет
«Харьковский политехнический институт», Украина
Получение
гидроксида кальция путем обработки извести растворами сахара
Разработке технологии и организации производства
высококачественного гидроксида кальция и оксида кальция из рядового
карбонатного сырья, а также удешевлению продукта реактивной квалификации в
настоящее время уделяется большое внимание.
Свойство извести давать растворимые в воде моно− и дисахараты
кальция [1 − 2] было нами использовано для разработки технологии
получения гидроксида и оксида кальция высокой степени чистоты и дисперсности.
Химизм происходящего процесса можно представить в виде следующих
уравнений [1 − 2]:
C12H22O11+CaO+2H2O→C12H22O11·CaO+2H2O (1)
C12H22O11·CaO+2H2O
+CO2→CaCO3+C12H22O11+2H2O (2)
CaCO3 ![]() CaO+CO2 (3)
CaO+CO2 (3)
CaO+H2O →Ca(OH)2. (4)
Технологический процесс включал следующие стадии: обжиг
карбонатного сырья; гашение извести раствором сахара; отделение шлама от
раствора моно− и дисахарата кальция; карбонизацию раствора с получением
пасты карбоната кальция; обжиг пасты до оксида кальция с последующим гашением
его до получения гидроксида кальция.
В качестве исходного сырья были использованы:
1) известь фракции 5 − 20 мм со следующим химическим составом (%): CaOобщ − 88,45; CaOакт − 79,50; СО2 − 2,76; MgO − 0,56; SiO2 + н/р в HCl − 3,01; Al2O3 + Fe2O3 − 1,55;
2) растворы рафинированного сахара и свекловичной патоки,
содержащей > 50% сахара, неорганических компонентов −
11,5 %.
Эквимолекулярные количества извести и раствора сахара смешивали в
реакторе в течение 30 минут. Полученную суспензию сахарата кальция подвергали
механической очистке для отделения твердых нерастворимых веществ, после чего
раствор обрабатывали углекислым газом. Осаженный карбонат кальция репульпировали
водой. Пасту карбоната кальция обжигали до оксида кальция в шахтной печи при температуре
1000 оС (с последующим гашением дистиллированной водой в гидроксид кальция.
Количество вступившего в реакцию оксида кальция определяли по
известной методике.
Экспериментальные данные по исследованию зависимости количества
оксида кальция, перешедшего в раствор, от концентрации сахара в растворе
обрабатывали на ЭВМ с
использованием программы статистической обработки данных, которая основана на
методах корреляционного, дисперсионного и регрессионного анализа.
Термическую стойкость и фазовые превращения продукта изучали на
дериватографе фирмы «MOM» (Венгрия) при
скорости нагревания 10 град/мин.
Рентгенофазовый анализ проводили на дифрактометре Дрон-2,0 в
медном излучении с никелевым фильтром.
При обработке экспериментальных данных получены математические
модели, имеющие общий вид:
![]()
где ![]() − количество СаО, перешедшей в раствор, %;
− количество СаО, перешедшей в раствор, %;
![]() − массовая
доля сахара в растворе.
− массовая
доля сахара в растворе.
По расчетным данным построены кривые зависимости количества оксида кальция
в растворе от концентрации сахара для температур 18 и 65 °С, представленные на
рис. 1.
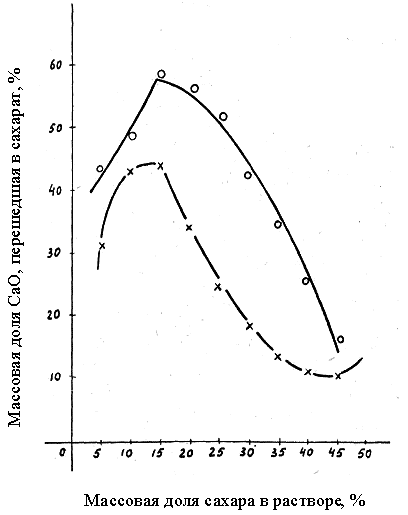
ο − 65 ; ×
– 18
Рис. 1. Влияние содержания сахара в растворе на количестве оксида кальция, перешедшего в сахарат, зри температуре
Из анализа данных, приведенных на рис.
1, следует, что при гашении извести 15 %-ным раствором, сахара наблюдается максимальная степень перехода оксида кальция в раствор в виде моно− и дисахарата кальция, которая составляет 63 % для раствора с температурой 65 °С и 46 % − для раствора с Т = 18 °С.
Установлено, что при повышении температуры раствора сахара до 80 °С количество СаО в растворе резко уменьшилось в связи с образованием трисахарата кальция, который выпадал в осадок.
С цель выявления возможности удешевления процесса рафинированный сахар был заменен свекловичной патокой − полупродуктом сахарного производства.
Так как
темный цвет получаемой суспензии при большой концентрации сахара затруднял определение количества оксида кальция, перешедшего в раствор, патоку разбавляли до массовой доли сахара не более 15 %.
Зависимость количества оксида кальция, перешедшего в раствор в виде моно−
и дисахарата кальция, от концентрации сахара в патоке представлена на рис.
2. Очевидно, что максимальное количество оксида кальция, перешедшего в раствор, наблюдалось при массовой доле сахара в патоке 10 % и составляло 63 % для температуры 65 оC. Это почти на 30 % выше, чем при
этих же условиях для раствора рафинированного сахара.
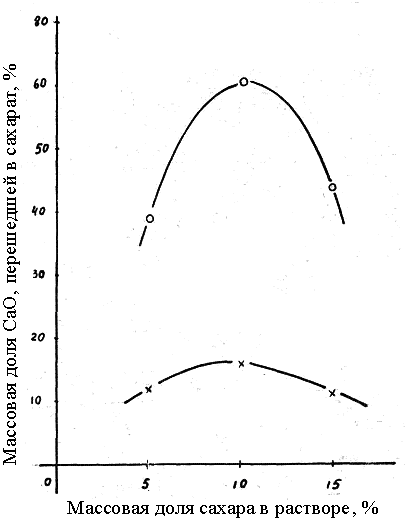
Рис. 2. Влияние содержания сахара в патоке на количество оксида кальция, перешедшего в сахарат, при температуре (оС):
о − 65 ; × – 35
Однако при температуре 35 °С количество СаО, перешедшей в моно−
и дисахарат, на 15 % ниже, чем при 18 °С в случае применения раствора рафинированного сахара.
Полученные данные позволяют сделать вывод о
том, что присутствие в патоке органических и неорганических примесей положительно влияет на процесс образования растворимых сахаратов кальция и позволяет
применять для извлечения оксида кальция растворы с меньшим содержанием сахара.
Растворы моно− и
дисахарата кальция карбонизировали при одинаковых условиях до щелочности
раствора 0,05 − 0,1 %. В результате получали легко фильтрующийся
кристаллический осадок карбоната кальция.
Образцы карбоната кальция прокаливали при температуре 950 °С.
Образцы, приготовленные с использованием раствора рафинированного сахара, после
прокалки содержали до 97 %, а при использовании патоки − до 90 % СаОакт. Затем образцы
оксида кальция обрабатывали дистиллированной водой.
Из таблицы 1, в которой приведен химический состав гидроксида
кальция, видно, что гидроксид кальция, полученный с применением рафинированного
сахара, представляет собой высококачественный продукт с содержанием основного вещества
более 97 %; гидроксид, приготовленный с использованием патоки, содержит 89 %
основного вещества.
Таблица 1 − Химический состав гидроксида кальция, полученного в лабораторных условиях
|
Компоненты |
Гидроксид кальция, полученный с применением |
|
|
рафинированного сахара |
свекловичной патоки |
|
|
Ca(OH)2 |
97,5 |
89,01 |
|
MgO |
0,1 |
1,05 |
|
CO2 |
0,6 |
2,71 |
|
SiO2 + н.p. в HCl |
0,05 |
2,70 |
|
SiO2 |
− |
2,45 |
|
Fe2O3 |
0,06 |
0,38 |
|
Al2O3 |
0,07 |
0,27 |
|
Влага |
0,3 |
0,4 |
В последнем случае высокий процент примесей объясняется тем, что в
процессе карбонизации при образовании мелкодисперсного карбоната кальция
происходит адсорбция неорганических примесей, содержащихся в патоке.
Рентгеноструктурный анализ шламов подтвердил результаты, полученные в
случае применения раствора рафинированного сахара. Идентификация межплоскостных
расстояний показала присутствие Са(ОН)2
α/n − 2,628Ǻ; СаCO3 α /n – 3,035 Ǻ; СaО α /n – 2,405Ǻ; α – SiO2 α/n – 3,34 Ǻ; α – Fe2O3 – 2,69Ǻ; Ca8Al4O12SO4 α/n – 8,3Ǻ.
Состав шлама свидетельствует о том, что при гашении извести раствором сахара в исследуемом интервале параметров процесса в раствор переходит только моно− и дисахарат кальция. При гашении извести раствором патоки в растворе остаются органические соединения, которые в дальнейшем загрязняют продукт.
Дериватограмма гидроксида кальция, полученного с использованием патоки, представлена на рис.
3, из которого видно, что при температуре 550°С на
кривой ДГА имеет место эндотермический эффект, который вызван разложением Са(ОН)2 и отсутствуют
термоэффекты, связанные с превращениями или выгоранием примесей.
Таким образом, в результате проведенных исследований установлена реальная возможность получения высококачественного гидроксида кальция из обожженного
рядового карбонатного сырья с использованием растворов сахара.
Предварительная технико-экономическая оценка предложенной
технологии по стадиям, включая и обжиг карбонатного сырья, показала, что
себестоимость гидроксида кальция составит около 197,2 дол/т. Это значительно
меньше себестоимости 2800 дол/т продукта реактивной квалификации, выпускаемого в настоящее время
на ряде предприятий.
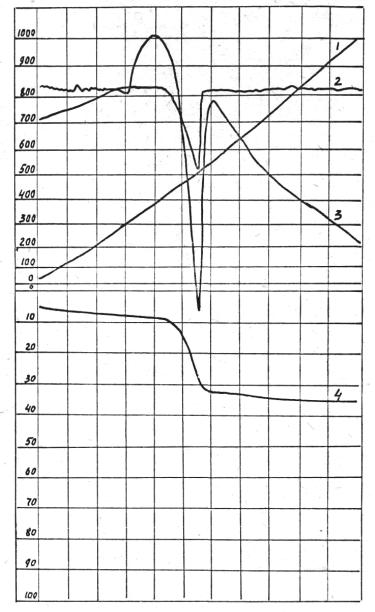
Рис. 3. Дериватограммы гидроксида кальция:
1 − кривая нагревания, Т°С;
2 − дифференциальная термогравиметрическая кривая (ДТ);
3 − дифференциальная термическая кривая (ДТА);
4 − термогравиметрическая
кривая (У)
Использованная литература:
1. Пат. 3340003 (США). Способ получения соединений
щелочноземельных металлов высокой чистоты / Ohio Lime Co. Кл. 23−66.
Опубл. 5.09.67.
2. Силин П.М. Технология сахара. − М.: Пищевая промышленность,
−1967. − 250 с.