Химия и химические
технологии (5)
1Бондарев Н.В., 2Зайцева
И.С., 3Керн А.П., 3Ларина О.В.
1Национальный университет им. В.Н. Каразина, Харьков
2Харьковская национальная академия городского хозяйства
3Институт химии национального университета им. В.Н.
Каразина, Харьков
ЭФФЕКТЫ СРЕДЫ И
КОМПЛЕКСООБРАЗОВАНИЕ
КАТИОНОВ НАТРИЯ, КАЛИЯ, АММОНИЯ И СЕРЕБРА (I)
С 18-КРАУН-6 В
РАСТВОРИТЕЛЯХ ВОДА-ПРОПАН-2-ОЛ
При
сольватационно-термодинамическом анализе влияния эффектов среды на химическое
равновесие первостепенное значение приобретает нормировка стандартного состояния
для реагентов. Важность
этой проблемы обусловлена расширением исследований химических равновесий в
неводных и многокомпонентных растворителях. Сопоставительный
анализ термодинамики химических равновесий в различных растворителях может быть
проведен только при условии, если в сравниваемых системах количества растворенных
реагентов соотнесены с одинаковыми количествами растворителя. Этому условию отвечает
нормировка стандартного состояния для реагентов в сольвомоляльной [1] (аквамоляльной
– при выборе воды в качестве среды
сравнения) шкале.
Рассматриваются
результаты сопоставительного термодинамического и корреляционного анализа
влияния аквамоляльных сольватационных эффектов водно-пропан-2-ольных
растворителей на устойчивость комплексов натрия, калия, аммония и серебра (I) с эфиром 18-краун-6 (L) и термодинамическая интерпретация катионной
селективности L в стандартном состоянии.
Установлено, что
константы устойчивости комплексов ML (M º Na+, K+, NH4+,
Ag+) при 298.15К уменьшаются в ряду: ![]() >
> ![]() >
> ![]() >
> ![]() – в воде и
– в воде и ![]() >
> ![]() >
> ![]() >
> ![]() – в пропан-2-оле.
– в пропан-2-оле.
Показано, что в воде,
спирте и смешанных растворителях с содержанием пропан-2-ола до X2-PrOH
£ 0.5 координация катионов натрия и
калия с краун-эфиром сопровождается образованием энтальпийно стабилизированных
комплексов (DrHо < 0, DrSо < 0); при X2-PrOH
³ 0.6 образуются энтропийно стабилизированные
коронаты (DrHо > 0, DrSо > 0). Устойчивость монокоронатов аммония в
водно-пропан-2-ольных растворителях имеет энтальпийную природу, а взаимодействие
энтальпийного и энтропийного эффектов образования комплексов серебра (I) с краун-эфиром приводит к
экстремальному характеру зависимости константы устойчивости короната серебра от
состава водно-пропан-2-ольного растворителя – наличию минимума при X2-PrOH
= 0.3–0.4 мол. доли.
Выявленные в работе
термодинамические закономерности координации катионов с эфиром 18-краун-6
подтверждаются линейными энтальпийно-энтропийными корреляциями ТDrSо = aDrHо + (ТDrSо)o, известными в научной литературе как
компенсационный эффект (табл. 1).
Таблица 1. Коэффициенты уравнения ТDrSо = aDrHо + (ТDrSо)o
|
Коронат |
(ТDrSо)о |
a |
r |
s |
Fнабл |
Границы применимости |
|
LNa+ |
14.2±0.8 |
0.31±0.03 |
0.999 |
0.79 |
7767 |
0.2£ X2-PrOH £ 0.8 |
|
LК+ |
19.9±0.6 |
1.11±0.02 |
0.999 |
0.63 |
18741 |
0.2 £ X2-PrOH £ 0.9 |
|
LNH4+ |
–1.6±0.8 |
0.37±0.03 |
0.998 |
0.26 |
1289 |
0 £ X2-PrOH £ 0.6 |
|
LAg+ |
9.2±1.1 |
0.97±0.08 |
0.994 |
1.2 |
698 |
0 £ X2-PrOH £ 1.0 |
Примечание. a – количественная мера компенсации энтальпии энтропийным эффектом комплексообразования (если a < 1 – в устойчивости комплексов преобладают энтальпийные эффекты, при a > 1 – энтропийные); DrGо = –(ТDrSо)о, если a = 1 (DrGо = (1–a)DrHо – (ТDrSо)о); s – стандартная ошибка аппроксимации; r – коэффициент корреляции; Fнабл – наблюдаемый критерий Фишера-Снедекора (F-распределение).
Для оценки влияния
водно-пропан-2-ольных растворителей на устойчивость краун-эфирных комплексов
использовано линейное однопараметрическое уравнение (табл. 2): DrGо = A1 + B1×d2N (где d2N – нормализованная плотность энергии когезии
смешанного растворителя).
Таблица 2. Коэффициенты уравнения DrGо = A1 + B1×d2N
|
Коронат |
A1 |
B1 |
s |
r |
Fнабл |
Границы |
|
LNa+ |
–14 ± 4 |
11± 6 |
0.62 |
0.985 |
63.4 |
0 £ X2-PrOH £ 0.5 |
|
LK+ |
–22.2 ± 1.6 |
11± 2 |
0.46 |
0.986 |
141.9 |
0 £ X2-PrOH £ 0.5 |
|
LNH4+ |
–32.6 ± 1.3 |
28 ± 2 |
0.58 |
0.997 |
944.2 |
0 £ X2-PrOH £ 0.7 |
|
LAg+ |
–15.4 ± 2.5 |
17 ± 7 |
0.51 |
0.937 |
35.6 |
0.4 £ X2-PrOH £ 1.0 |
Знаки при коэффициентах
регрессии свидетельствуют о возрастании устойчивости комплексов с уменьшением
плотности энергии когезии смешанных растворителей. Уменьшение энергии
когезионных взаимодействий растворитель-растворитель способствует стабилизации
(сольватации) растворенных частиц, поэтому при координации катионов с краун-эфиром
cмешанный растворитель вода-пропан-2-ол в большей мере стабилизирует комплексные
частицы МL, чем исходные реагенты – катионы и краун-эфир, что в конечном итоге и
обусловливает рост устойчивости коронатов.
Показано, что
коронаты натрия, калия и аммония по характеру влияния сольватации реагентов на
устойчивость относятся к комплексам III типа, согласно
сольватационно-термодинамической классификации [2].
Взаимосвязь между
катионной селективностью краун-эфира КML+/КNаL+ по отношению к паре
катионов М+ – Na+ (M+ º К+,
NH4+, Ag+) и термодинамическими характеристиками
пересольватации реагентов имеет вид [3]
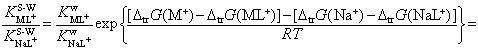
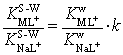 ,
,
здесь ![]() – коэффициент
катионной селективности краун-эфира показывает, как изменяется селективность
лиганда по отношению к паре катионов М+ – Na+ в растворителе S-W
– коэффициент
катионной селективности краун-эфира показывает, как изменяется селективность
лиганда по отношению к паре катионов М+ – Na+ в растворителе S-W ![]() по сравнению с
селективностью в воде
по сравнению с
селективностью в воде ![]() .
.
Селективность краун-эфира к ионам калия в
водно-пропан-2-ольном растворителе по сравнению с водой (KKL+/KNaL+ = 35) вначале уменьшается (k = 0.8, X2-PrOH = 0.1 мол. доли), при X2-PrOH
= 0.2 мол. доли - такая же, как в воде (k
= 1.0), а в дальнейшем возрастает до KKL+/KNaL+ = 56 (k = 1.6, X2-PrOH = 0.4 мол. доли). Селективность краун-эфира по отношению к паре
катионов NH4+ – Na+ возрастает от K(LNH4+)/K(NaL+) = 2.5 в воде до K(LNH4+)/K(NaL+) = 224 (k =
87, X2-PrOH
= 0.4 мол. доли). Для пары ионов Ag+ – Na+ увеличение
содержания пропан-2-ола в смешанном растворителе сопровождается уменьшением
катионной селективности эфира 18-краун-6: в воде KAgL+/KNaL+ = 16, a при X2-РrOH > 0.1 KAgL+/KNaL+ = 1.6.
1.
Абросимов В.К. Современные проблемы химии
растворов. М.: Наука,1986. С. 97.
2.
Бондарев Н.В., Кабакова Е.Н., Ельцов С.В.,
Зайцева И.С. // ЖФХ. 2003. Т.77. №10. С.1783.
3.
Бондарев Н.В. // ЖОХ. 2007. Т.76. Вып.1. С.
13.
ЗАЯВКА НА УЧАСТИЕ В КОНФЕРЕНЦИИ
"Эффективные инструменты современных наук
– 2007"
Украина, Днепропетровск
3-15 мая 2007год.
1. Бондарев Н.В. – к.х.н., доцент, доцент
кафедры физической химии, Харьковский национальный университет им. В.Н. Каразина,
61077, г. Харьков, пл. Свободы, 4, тел. (057)707-54-45, Е-mail: bondarev_n@rambler.ru
2. Зайцева И.С. – к.х.н., старший
преподаватель, Харьковская национальная академия городского хозяйства, 61002,
г. Харьков, ул. Маршала Бажанова, 17, тел. (057)707-31-01
3. Керн А.П. – к.х.н., старший
научный сотрудник, Институт химии национального университета им. В.Н.
Каразина, 61077, г. Харьков, пл. Свободы, 4
4. Ларина
О.В. – младший научный сотрудник, Институт химии национального
университета им. В.Н. Каразина, 61077, г.
Харьков, пл. Свободы, 4