ХИМИЯ И ХИМИЧЕСКИЕ ТЕХНОЛОГИИ / 5. Фундаментальные проблемы создания новых материалов и технологий
К. т. н. Майдан Д. А.
ГОУВПО «Самарский государственный технический
университет»,
Самара
Химическая стадийность образования
нитридов железа,
кобальта и никеля в режиме самораспространяющегося
высокотемпературного синтеза с использованием
азида натрия и галоидных солей аммония
В 1967 году в Отделении Института
химической физики АН СССР академиком А. Г. Мержановым, профессорами И. П.
Боровинской и В. М. Шкиро разработан способ синтеза тугоплавких соединений, в
том числе нитридов, который получил название самораспространяющийся
высокотемпературный синтез (СВС). Технология СВС относится к порошковым
технологиям, но она принципиально отличается от традиционных технологий порошковой
металлургии тем, что для осуществления процесса азотирования исходные порошки
сжигают, а не нагревают в печи. Процесс СВС идет за счет собственного тепловыделения,
без подвода энергии извне, в простых, компактных аппаратах, а не в громоздком
высокотемпературном оборудовании. Отсутствие длительного и энергоемкого нагрева
в печи — одно из главных преимуществ технологии СВС. Высокие температуры
горения обеспечивают полноту превращения исходных элементов в конечные продукты
и способствуют испарению примесей, поэтому продукты синтеза имеют высокую
чистоту. Большие скорости горения обеспечивают высокую производительность
процесса. Однако классическим методом СВС, с использованием газообразного азота
в качестве азотирующего реагента, нитриды металлов группы железа получить не
удается, так как реакция образования нитрида железа является крайне
слабоэкзотермичной, а реакции образования нитридов кобальта и никеля являются
эндотермичными. Использование азида натрия в качестве азотирующего реагента и
галоидных солей аммония для химической нейтрализации азида в процессах горения
позволяет решить вопрос синтеза нитридов металлов группы железа за счет тепла,
выделяющегося при горении азида натрия и галоидной соли. Это так называемая
азидная технология самораспространяющегося высокотемпературного синтеза
(СВС-Аз).
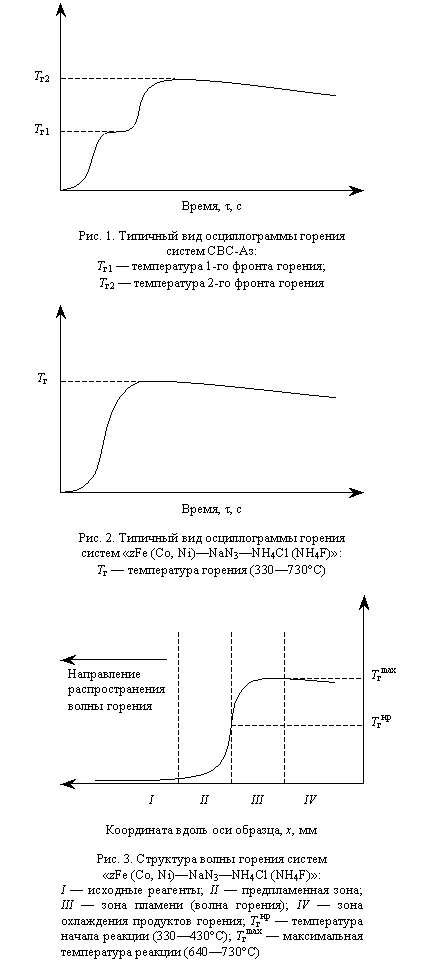
При горении большинства систем СВС-Аз
наблюдаются два независимых фронта горения, которые можно условно разделить на
низко- и высокотемпературный (рис. 1). Однако существует ряд систем, у которых,
несмотря на доказанное наличие низкотемпературной реакции между азидом натрия и
галоидной солью аммония, на температурных профилях осциллограмм низкотемпературный
фронт горения отдельно не проявляется, а сливается с высокотемпературным
фронтом горения [1]. В основном, это системы «элемент — азид натрия — галоидная
соль аммония»: «Si—NaN3—NH4Cl», «B—NaN3—NH4Cl»,
«Ti—NaN3—NH4F», «Zr—NaN3—NH4Cl (NH4F)»,
«Hf—NaN3—NH4Cl (NH4F)», «V—NaN3—NH4Cl
(NH4F)».
Практические исследования синтеза нитридов
металлов группы железа в режиме СВС-Аз показали, что системы «металл группы
железа (Fe, Co, Ni) — азид натрия — хлорид (фторид) аммония» имеют
только один фронт горения (рис. 2). Условно разделим фронт горения на низко- и
высокотемпературные части. В низкотемпературной части фронта горения будут
протекать реакции разложения азида натрия и взаимодействия натрия с галоидной
солью аммония. В высокотемпературной части фронта горения будет протекать
реакция азотирования металла группы железа (рис. 3).
Теоретические термодинамические расчеты,
выполненные с использованием программы Thermo, разработанной в Институте структурной макрокинетики
и проблем материаловедения РАН, показали, что адиабатическая температура
стехиометрической по азоту химической реакции «16Fe + NaN3 + NH4Cl (NH4F)» составляет 221°С (240°С), реакции «12Co + NaN3 + NH4Cl (NH4F)» — 111°С (135°С), реакции «12Ni + NaN3 + NH4Cl (NH4F)» — 157°С (179°С). Причем, температуры реакций не
зависят от давления внешнего азота. Системы с такими низкими адиабатическими
температурами не способны к горению.
![]()
![]()
![]()

Практические исследования синтеза нитридов
металлов группы железа в режиме СВС-Аз показали, что системы, описываемые
стехиометрическими по азоту уравнениями, в условиях лабораторного СВС-Аз
реактора действительно не горят, что можно объяснить малым количеством горючих
элементов.
Синтез в режиме горения наблюдается только
в системах, описываемых нестехиометрическими уравнениями реакций, с недостатком
азотируемого элемента, но с увеличенным количеством горючих элементов. Системы
«железо — азид натрия — хлорид (фторид) аммония» с недостатком железа, в
которых в процессе синтеза образуется нитрид железа Fe4N, при давлении
азота в реакторе СВС-Аз 5 МПа горят при температурах 330—660°С; системы
«кобальт — азид натрия — хлорид (фторид) аммония» с недостатком кобальта при
давлении азота 5 МПа горят при температурах 430—640°C, однако в продуктах горения нитриды кобальта
обнаружены не были, поскольку температура разложения Co2N составляет
276°С, а Co3N — 327°С [2, 3]; системы «никель — азид натрия —
фторид аммония» с недостатком никеля, в которых в процессе синтеза образуется
нитрид никеля Ni3N, при давлении азота 5 МПа горят при температурах
430—730°C. Теоретические термодинамические расчеты показали,
что адиабатическая температура нестехиометрической по азоту химической реакции
с недостатком железа «12Fe + NaN3 + NH4Cl (NH4F)» при давлении
внешнего азота 5 МПа составляет 307°С (324°С). С уменьшением количества железа
в исходной системе адиабатическая температура реакции растет: температура
реакции «Fe + NaN3 + NH4Cl (NH4F)» при давлении
внешнего азота 5 МПа составляет 472°С (508°С). Аналогичная картина наблюдается
при расчетах адиабатических температур реакций с кобальтом и никелем:
температура реакции «9Co + NaN3 + NH4Cl (NH4F)» при давлении
внешнего азота 5 МПа составляет 248°С (270°С), реакции «1,5Co + NaN3 + NH4Cl (NH4F)» — 327°С (327°С), реакции «9Ni + NaN3 + NH4Cl (NH4F)» — 272°С (291°С), реакции «1,5Ni + NaN3 + NH4Cl (NH4F)» — 360°С (360°С). Причем, с увеличением давления
внешнего азота адиабатическая температура реакций слабо растет.
Опираясь на результаты, представленные в
работах [1, 4, 5], определим химическую стадийность образования нитридов в
системах «металл группы железа — азид натрия — хлорид (фторид) аммония».
Стехиометрические по азоту уравнения образования нитридов металлов
группы железа можно представить так:
4xMe + NaN3
+ NH4Ha ® 4MexN + NaHa
+ 2H2, (1)
где Me — металл
группы железа (Fe, Co, Ni); Ha — галоген (Cl, F); x —
стехиометрический коэффициент (для железа x = 2, 3, 4; для кобальта x = 2, 3; для никеля x = 3).
Реакции низкотемпературной части фронта
горения:
NaN3 ® Na + 11/2N2; (2)
Na + NH4Ha
® NaHa + NH3 + 1/2H2. (3)
Суммарная реакция низкотемпературной части
фронта горения
NaN3 +
NH4Ha ® NaHa + NH3
+ 11/2N2 + 1/2H2. (4)
Реакции высокотемпературной части фронта
горения:
xMe + NH3 ® MexN
+ 11/2H2; (5)
3xMe + 11/2N2
® 3MexN. (6)
Суммарная реакция высокотемпературной
части фронта горения
4xMe + NH3
+ 11/2N2 ® 4MexN
+ 11/2H2. (7)
Химическая стадийность образования
нитридов металлов группы железа в системах, описываемых нестехиометрическими
уравнениями реакций, будет отличаться от рассмотренной выше тем, что в реакциях
высокотемпературной части фронта горения не весь азот и азот аммиака, выделившегося
в низкотемпературной части фронта горения, будут связываться в нитрид. Часть
азота и аммиака будет выделяться в атмосферу реактора. Это основное отличие
химической стадийности образования нитридов металлов группы железа из систем
«металл группы железа — азид натрия — хлорид (фторид) аммония» от химической
стадийности, предлагаемой авторами работ [1, 4, 5] для других аналогичных
систем СВС-Аз.
Нестехиометрические по азоту уравнения реакций образования нитридов
металлов группы железа можно представить уравнением:
zMe + NaN3 + NH4Ha ®
® z/xMexN + NaHa + yNH3 + (2 – 3y/2)H2 + (2 – z/2x – y/2)N2, (8)
где y —
количество образующегося аммиака, зависящее от давления внешнего азота (0 < y
<1), моль; z — количество металла группы
железа в исходной системе (для железа и кобальта z < 8, для никеля z < 12), моль.
Выделение газообразного азота и аммиака в
процессе горения систем, описываемых нестехиометрическими уравнениями реакций с
недостатком азотируемого элемента, подтверждается теоретическими
термодинамическими расчетами.
Литература
1. Бичуров Г. В.
Самораспространяющийся высокотемпературный синтез нитридов с применением
неорганических азидов и галоидных солей: Дис. … д-ра техн. наук. — Самара, 2003.
— 250 с.
2. Самсонов Г. В. Нитриды. —
Киев: Наукова думка, 1969. — 380 с.
3. Самсонов Г. В., Кулик О. П.,
Полищук В. С. Получение и методы анализа нитридов. — Киев: Наукова думка,
1978. — 318 с.
4. Левашев А. Ф.
Самораспространяющийся высокотемпературный синтез нитридов переходных металлов
IV группы и алюминия с применением неорганических азидов: Дис. … канд. техн.
наук. — Куйбышев, 1983. — 155 с.
5. Макаренко А. Г.
Самораспространяющийся высокотемпературный синтез ультрадисперсного порошка
нитрида бора с применением неорганических азидов и галоидных солей: Дис. …
канд. техн. наук. — Куйбышев, 1990. — 169 с.