6.Органическая химия.
К.х.н. 1 Валюк В.Ф., к.х.н. 2 Шилін С.В.
1Уманський державний
педагогічний університет ім. Павла Тичини, природничо-географічний факультет,
кафедра хімії та екології, 02003, Україна, Умань, вул. Садова 2, e-mail: Vvalyuk@mail.ru
2 Київський
національний університет імені Тараса Шевченка, хімічний факультет, кафедра
органічної хімії. 01033 Україна, Київ, вул. Володимирська, 64.
Біологічна
активність кумаринів
Похідні
кумарину, як природні, так і синтетичні виявляють різноманітну фізіологічну
активність. Хоча роль та функції кумаринів в рослинах до цього часу остаточно
не визначені, багато хто вважає, що вони можуть грати роль фітоалексинів.
Бензопіранони утворюються у відповідь на несприятливі умови середовища: на
травматичне пошкодження рослин або при їх захворюванні, захищаючи рослину від
грибкової, бактеріальної або вірусної інфекції, а також можуть бути своєрідними
регуляторами росту рослин чи просто кінцевими продуктами метаболізму. На
сьогодні відомо щонайменше 30 різних видів біологічної дії цих сполук [1].
В наш час
серцево-судинні захворювання, рак, ВІЛ та інші інфекційні захворювання,
складають найбільш серйозну загрозу здоров’ю людини. Тому для практичної
медицини найбільше значення має антикоагулянтна, протиракова та анти-ВІЛ дія
кумаринів. Важливо також, що похідні бензопіранону проявляють спазмолітичну,
капіляроукріплюючу, протизапальну, жовчогінну, фотосенсибілізуючу активність. В
літературі наведено також дані про кумарини з антибактеріальним,
антигельмінтним, гіпотермічним і вазоділататорним ефектом.
В медичній
практиці застосовують в якості антикоагулянтів непрямої дії варфарин 1
[2] та похідні 4-гідроксикумарину 2, 3, що є антагоністами вітаміну К,
який бере участь в біосинтезі протромбіну.
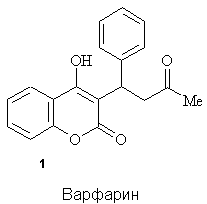
Для
кумаринів, що проявляють антикоагулянтну активність, важливою структурною
особливістю є наявність 4-гідроксильної групи і присутність замісника в 3-му
положенні гетероциклу.
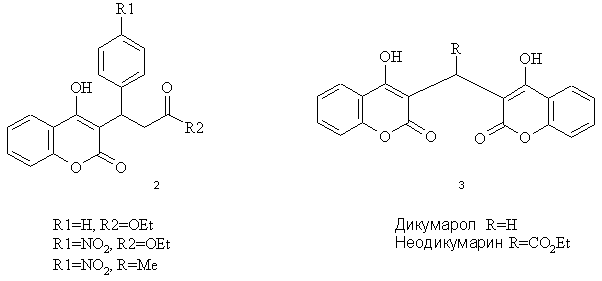
Похідні
кумарину ескузан та есфлазин, що є діючими речовинами препаратів кінського
каштану, застосовують в якості ангіопротекторів, які покращують мікроциркуляцію
крові, нормалізують проникність судин і позитивно впливають на метаболічні
процеси у стінках кровоносних судин.
Оскільки
кумарини та гетероцикли з вузловим атомом азоту мають високий фармакологічний потенціал, а ансамблі циклів, які містять
у своїй структурі вказані системи, викликають підвищену цікавість дослідників,
в роботі [3] було здійснено циклоконденсацію 3-(α-бромацетил)-кумаринів з
2-амінопіридинами, 2-амінопіримідином і 2-метилпіридином, що привело до
одержання гетероциклів, які містять в положенні 3 кумарину
імідазо[1,2-a]піридинову, імідазо[1,2-a]піримідинову або піроло[1,2-a]піридинову
ланку і показано, що вони виявляють високу протиракову активність у відношенні
клітин раку молочної залози та клітинних культур лейкемії.
Неодноразово
зазначалося, що кумарини є антиоксидантами [4]. Було знайдено, що похідні цього
гетероциклу можуть бути не лише інгібіторами ліпоксигеназного і
циклооксигеназного шляху метаболізму арахідонової кислоти, але вони також
здатні впливати на нейтрофіл-залежну генерацію супероксидного радикалу.
Є відомості,
що фурокумарини проявляють анти-ВІЛ та антибактеріальну активність.
Leung та ін.
[5] показали, що ескулетин (6,7-дигідроксикумарин) проявляє на макрофагах та
лімфоцитах імуномодуляторну активність, яка може бути одним з механізмів
захисної і протипухлинної дії кумаринів.В роботі de Souza та ін. [6] досліджено
антибактеріальну активність 45 похідних кумарину на штаммах Bacillus cereus
MIP 96016, Escherichia coli ATCC 25922, Pseudomonas aeruginosa
ATCC 278953, Staphylococcus aureus ATCC 25923 та показано, що найбіль
ефективним проти грампозитивних бактерій є остенол 4 (МІС 62,5-125
мкг/мл) .
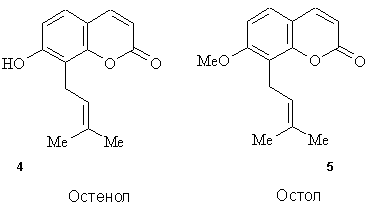
На штаммах
Staphylococcus aureus, Salmonella paratypi, Escherichia coli Pawar та ін.
виявили антибактеріальну активність 4-гідроксикумаринів, які містять певні
гетероцикли, й показали, що величина MIC для них складає 25-100 мкг/мл.
Найбільш активними виявилися сполуки 6, 7.
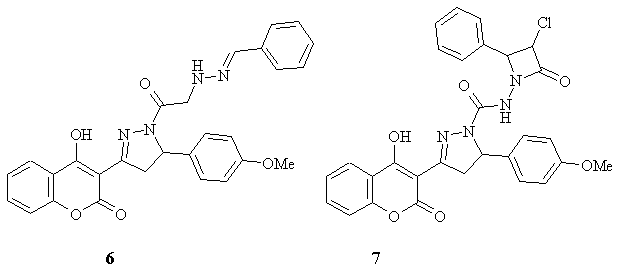
Говорячи про
біологічні властивості кумаринів, не можна не відзначити високу токсичність
деяких з них. Так, вельми небезпечними мікотоксинами є група метаболітів Aspergillus
flavus, з яких найбільш підступні афлатоксини В1 та М1..
Вважають, що в Африці вони спричиняють рак печінки, а в Індії зумовлюють цироз
печінки у дітей.
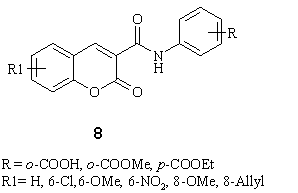
Багато
кумаринів виявляють протизапальну активність. Карагениновий набряк придушується
сеселіном, кумарином, умбеліфероном та іншими бензопіранонами. В.Л.Черних та
інші синтезували похідні 2Н-[1]бензопіран-3-карбоксаміду і вивчили їх
протизапальну активність на моделі карагенинового набряку, показавши, що ефект
деяких сполук 8 практично збігається з активнісю препаратів порівняння
(піроксикаму).
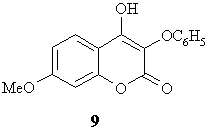
Для
дослідження фармакологічного спектру феноксипохідних бензопіранону] здійснено
синтез кумарину 9 за методом Костанецького-Робінсона та вивчено його
біологічні властивості. Виявилося, що ця сполука має вельми цікаві біологічні
характеристики: за величиною жовчогінної, гепатозахисної, гіпотригліцеридемічної
та антиоксидантної дії вона переверщує препарати, які використовують у медичній
практиці.
Похідні кумарину використовують у медицині як
антикоагулянти, що є конкурентними інгібіторами вітаміну К у біосинтезі
протромбіну. Багато аналогів цього класу сполук володіють гіпотензивною,
протимікробною, гіпотермічною, антигельмінтною дією, а також виявляють
активність як антибіотики, антиалергени, фунгіциди і таке інше. Велику
цікавість викликає їх спазмолітична дія, висока фотосенсибілізуюча активність,
яку мають деякі фурокумарини, та потужна антиоксидантна активність.
З огляду на сказане, можна стверджувати, що синтез нових
амінокислотних та пептидних похідних кумарину, а також вивчення їх хімічних
властивостей та біологічної активності, представляє велике наукове і практичне
значення для біоорганічної хімії, оскільки зазначені похідні демонструють
фактично необмежені можливості для їх модифікації та створення нових
біоактивних речовин.
Література:
1.
Кузнецова Г.А. Природные кумарины и фурокумарины.-
Ленинград: «Наука», 1967 – 248с.
2.
Hirsh J., Dalen J.E., Anderson D.R., et al., Oral anticoagulants: Mechanism of action, clinical effectiveness, and
optimal therapeutic range. // Chest. – 2001. - Vol. 119, 1. - P. 8S-21S.
3.
Орленко И.В., Коваленко С.Н., Журавель И.А. и др. Ансамбли циклов с кумариновым звеном. 4. Синтез
3-(имидазо[1,2-а]пиридинил-2)-, 3-(имидазо[1,2-а]пиримидинил-2)- и
3-(пирроло[1,2-а]пиридинил-2)кумаринов. // Фізіол. активні речовини.- 2001. -
№2 (32). – С. 25-28.
4.
Kostova I.
Synthetic and natural coumarins as cytotoxic agents. // Curr. Med. Chem. Anti-Cancer agents. – 2005. – Vol. 5, № 1.-
P. 29-46.
5.
Leung K.N., Leung P.Y., Kong L.P., Leung PK. Immunomodulatory effects of esculetin
(6,7-dihydrooxycoumarin) on murine lymphocytes and peritoneal
macrophages. // Cell Mol. Immunol.-2005. – Vol. 2, № 3. – P.181-188.
6.
de Souza S.M., Monache F.D., Smânia A. Antibacterial activity of coumarins. //
Z. Naturforsch. – 2005.- B. 60c, № ½. – S. 693-700.