1Е.В.
Демина, аспирант кафедры химии Курского государственного университета
2Н.Н.
Басаргин, доктор химических наук, профессор, заслуженный деятель науки РФ
1Курский государственный университет, г. Курск, Россия
2Институт геологии рудных месторождений,
петрографии, минералогии и геохимии РАН (ИГЕМ
РАН), г. Москва
Определение констант образования
комплексов Sr (II) с полимерными хелатообразующими сорбентами на основе полистирола с о
– гидрокси – азо – о, - гидрокси функциональной группой
Стронций относится к группе токсичных
элементов и способен оказывать негативное влияние на различные объекты
окружающей среды. Контроль за его
содержанием в различных объектах, является важной аналитической задачей. Прямое
определение стронция в природных и техногенных объектах в присутствии мешающих элементов приводит к значительному
снижению точности и чувствительности количественного определения современными
инструментальными методами анализа. Для расширения
возможностей физико-химических методов анализа в направлении индивидуального
определения элементов в сложных по составу объектах, наиболее перспективным
является использование полимерных комплексообразующих сорбентов. Применение сорбентов
позволяет значительно снизить пределы обнаружения элементов и устранить влияние
матричных компонентов.
Все исследуемые сорбенты, были
синтезированы на основе сополимера стирола с дивинилбензолом макропористой
структуры в Центральной химической лаборатории ИГЕМа [1]. Данные о структуре
сорбентов указаны в таблице 1.
Таблица 1.
Исследуемые сорбенты
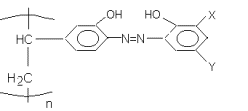 где X,Y –
различные заместители
где X,Y –
различные заместители
|
№ п/п |
Название сорбента |
Заместители |
|
|
-X |
-Y |
||
|
1 |
Полистирол -2-окси-азо-2/-окси,
3,5-динитробензол |
-NO2 |
-NO2 |
|
2 |
Полистирол -2-окси-азо-2/-окси,
5-нитро, 3-сульфобензол |
-SO3H |
-NO2 |
|
3 |
Полистирол -2-окси-азо-2/-окси,
5-сульфобензол |
-H |
-SO3H |
|
4 |
Полистирол -2-окси-азо-2/-окси,5-хлорбензол |
-H |
-Cl |
|
5 |
Полистирол -2-окси-азо-2/-окси-бензол |
-H |
-H |
|
6 |
Полистирол -2-окси-азо-2/-окси,
3,5-дисульфобензол |
-SO3H |
-SO3H |
|
7 |
Полистирол -2-окси-азо-2/-окси,
5-нитробензол |
-H |
-NO2 |
Сорбенты
представляют собой гранулы размером 0.25-1 мм темно- коричневого цвета,
нерастворимые в воде, кислотах, щелочах и органических растворителях. Для исследования были использованы
очищенные сорбенты в Н+ - форме.
Хелатные сорбенты способны образовывать с ионами металлов прочные
комплексные соединения. Константы устойчивости (lgb) комплексов металлов с функционально – аналитическими группами
(ФАГ) полимерного хелатного сорбента являются одной из важнейших характеристик
процесса комплексообразования и определяют возможность групповой или
индивидуальной сорбции. Применяются различные способы расчета этих констант,
основанные на измерении изменений концентрации иона металла в растворе при
контакте с комплексообразующими сорбентами [3]. Получаемые при расчете величины
констант устойчивости являются приближенными, так как невозможно учесть все
факторы, оказывающие влияние на процесс комплексообразования в гетерогенной среде.
Определяемые экспериментально константы образования являются концентрационными.
Однако эти величины характеризуют аналитические свойства сорбента.
Величину
lgb
определяли потенциометрическим методом по константе равновесия [5]. Для этого
10 навесок сорбента по 0,100 г помещали в бюксы вместимостью 35 мл и приливали
20 мл раствора NaNO3 (1 моль/л), содержащего различные количества
NaOH. При этом соотношение NaOH/сорбент меняли в интервале 0 моль NaOH/0,100 г
сорбента до величины СЕС. Затем добавляли во все растворы соль Sr (II).
После установления равновесия измеряли рН раствора. Концентрацию Sr (II)
в растворе после сорбции определяли фотометрическим методом c
реагентом нитхромазо [4] на спектрофотометре СФ-46.
Процесс
образования комплекса ионов металла Ме
с функциональными группами сорбента L
в общем виде может быть представлен схемой:
Ме + nL = MeLn
Константа
равновесия реакции соответствует константе образования комплекса и может быть
записана следующим образом
![]() (1),
(1),
или,
в логарифмической форме lg b = lg[MеLn] - lg[Ме] - nlg[L] (2).
Нерастворимость
сорбента и соответственно его хелата позволяет определить концентрацию
комплекса [MеLn] и концентрацию незакомплексованных ионов
металла [Ме] в системе при
равновесии.
Концентрация
незакомплексованных функциональных групп [L], находящихся в
координационно-активной форме, может быть определена из уравнения константы
диссоциации:
![]() (3),
(3),
где
[LH] = [Lобщ] - [NaOH] - [H+];
[NaOH] - концентрация
добавленного раствора щелочи, ммоль/мл;
[Н+] -
равновесная концентрация ионов водорода в системе, ммоль/мл.
Полученные данные для расчета констант
образования комплексов стронция с ПХС приведены в таблице. 2.
Таблица 2.
Результаты определения констант
образования комплексов стронция (II)
с ПХС
|
Сорбент |
[Ме].105, моль/л |
[МеLn].103, моль/г |
lg[L] |
lg[LH] |
lgb |
|
1 |
1,67 |
0,63 |
6,27 |
-2,11 |
7.31 |
|
2 |
1,49 |
0,39 |
-5,92 |
-1,34 |
7.02 |
|
3 |
1,61 |
0,54 |
-6,65 |
-2,04 |
7.72 |
|
4 |
1.51 |
0.41 |
-5.87 |
-1.49 |
6.98 |
|
5 |
1.48 |
0.47 |
-5.76 |
-1.05 |
6.77 |
|
6 |
1.58 |
0.59 |
-6.71 |
-0,99 |
7.69 |
|
7 |
1.55 |
0.62 |
-6.28 |
-1,75 |
7.14 |
Из полученных результатов видно, что
устойчивость комплексов подчиняется
закономерностям, характерным для мономерных органических реагентов [2] с той разницей,
что комплексообразование катионов стронция с функциональными группами,
закрепленными на полимерной матрице, связано со значительно большими
энергетическими затратами. Поэтому хелатные комплексы с полимерными сорбентами
менее прочны [5].
Литература:
1. Басаргин Н.Н., Розовский Ю.Г., Чернова Н.В. Синтез, исследование и
применение хелатообразующих сорбентов для концентрирования и определения
микроколичеств элементов в природных и сточных водах // Журн. аналит. химии. -
1992. - Т. 47. - № 5. - С. 787-793.
2. Басаргин Н.Н., Розовский
Ю.Г., Жарова В.М. и др. Органические хелатные сорбенты в неорганическом анализе. - В кн.: Органические
реагенты и хелатные сорбенты в анализе минеральных объектов. - М.: Наука, 1980.- С.82-116.
3. Бек М.,
Надьпал И. Исследование комплексообразования новейшими методами. - М.: Мир,
1989. - 412 с.
4.
Крешков А.П., Кузнецов В.В. //Журн.
аналит. химии. – 1970. Т.45. С. 45.
5. Салдадзе
К.М., Копылова-Валова В.Д. Комплексообразующие иониты. – М.: Химия, 1980. – С.
335