Степаненко Т.І., Башева Т.С.
Донбаська національна академія
будівництва і архітектури, Україна
Підвищення рівня екологічної
безпеки виробництва фенолу і ацетону
Актуальність роботи. Хімічна промисловість
являє собою одну із провідних галузей важкої індустрії, є науково-технічною і
матеріальною базою хімізації народного господарства й грає винятково важливу
роль у розвитку продуктивних сил і в забезпеченні життєвих потреб суспільства.
Фенол, і ацетон набули
широкого поширення. Фенол споживають у виробництвах епоксидних полімерів (лаки,
клеї); антиоксидантів, присадок до масел і палив; як розчинник на установці
селективного очищення масел, антисептиків, гербіцидів, інсектицидів;
пластифікаторів, пластмас та ін. [1; 2]. Ацетон
широко застосовують як розчинник і проміжний продукт органічного синтезу (для виробництва епоксидних полімерів і
полікарбонатів і інших коштовних речовин). У зв'язку з розвитком згаданих вище областей, є потреба в збільшенні продуктивності [3].
Мета
роботи: зменшити викид шкідливих речовин у атмосферне повітря при
виробництві фенолу та ацетону.
У наш час
широке розповсюдження серед всіх промислово розвинених країн світу одержав
кумольний метод спільного одержання фенолу і ацетону, тому що він набагато
більш економічніший усіх раніше реалізованих методів. Сучасний промисловий
метод одержання фенолу полягає в кислотно-катализізуємому розкладанні
гідропероксида кумолу. Окислення бензолу у фенол складається з 3 стадій: алкілірування
бензолу пропиленом з утворенням ізопропилбензолу; окислення кумолу киснем
повітря в гідропероксид при 100-130°С; розкладання гідропероксида кумолу на
фенол і ацетон при 60-100°С [3].
У процесі виробництва фенолу і ацетону кумольним методом утворюються
шкідливі речовини, що надходять в атмосферу. В основному – це продукти
розкладання гідропероксида кумолу.
Вплив температури на состав продуктів розкладання
гідропероксида кумолу показано нижче [4] (у мол. %):
|
|
110 °С |
137 °С |
160 °С |
|
Метан |
27 |
39 |
52 |
|
Ацетофенон |
30 |
50 |
63 |
|
Бензойна
кислота |
– |
0,9 |
2,4 |
|
Дикуміл |
21 |
26 |
29 |
|
α-Метилстирол |
0 |
2,5 |
0 |
|
α-Кумиловий
спирт |
141 |
130 |
106 |
|
Вода |
– |
31,9 |
25,6 |
Таким чином,
зроблено висновок, що при зниженні температури процесу знижується кількість
продуктів розкладання гідропероксида кумолу, що викидаються в атмосферу.
Підвищення
рівня екологічної безпеки виробництва фенолу і ацетону можливе шляхом зниження
температури процесу за допомогою реагентів – ініціаторів окислення. В роботі досліджено
швидкість окислення кумолу в гідропероксид (у присутності ініціатора окислення
– N-гідроксифталіміду) при різних температурах. Інтервал температур був обраний
35 – 60 °С. Для розрахунку швидкості окислення кумолу в гідропероксид використано
дані об’єму поглиненого кисню, отримані експериментальним шляхом.
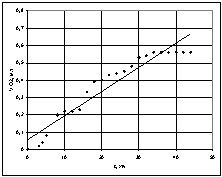
При температурі 35 °С (Т=308 К) залежність об’єму поглиненого
кисню від часу (рис.1) має лінійну залежність та описується рівнянням ![]() ,
, ![]() .
.
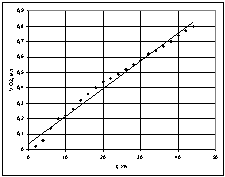
При температурі 40 °С (Т=313 К) залежність об’єму поглиненого кисню від часу (рис.2) має лінійну залежність та описується рівнянням ![]() ,
, ![]() .
.
|
|
|
|
Рис. 1 – Графік залежності
об'єму поглиненого кисню від часу при температурі 35 °С |
Рис. 2 – Графік
залежності об'єму поглиненого кисню від часу при температурі 40 °С |
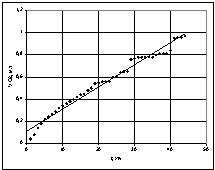
При температурі 45 °С (Т=318 К) залежність об'єму поглиненого кисню від часу (рис.3)
має лінійну залежність та описується рівнянням ![]() ,
, ![]() .
.
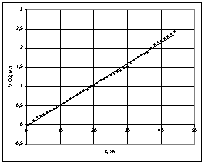
При температурі 50 °С (Т=323 К) залежність
об'єму поглиненого кисню від часу (рис.4)
має лінійну залежність та описується рівнянням ![]() ,
, ![]() .
.
|
|
|
|
Рис. 3 – Графік залежності
об'єму поглиненого кисню від часу при
температурі 45 °С |
Рис. 4 – Графік
залежності об'єму поглиненого кисню від часу при температурі 50 °С |
При температурі 55 °С (Т=328 К) залежність об'єму поглиненого кисню від часу (рис.5)
має лінійну залежність та описується рівнянням ![]() ,
, ![]() .
.
При температурі 60 °С (Т=333 К) залежність об'єму поглиненого кисню від часу (рис.6)
має лінійну залежність та описується рівнянням ![]() ,
, ![]() .
.
|
|
|
|
Рис. 5 – Графік залежності
об'єму поглиненого кисню від часу при температурі 55 °С |
Рис. 6 – Графік
залежності об'єму поглиненого кисню від часу при температурі 60 °С |
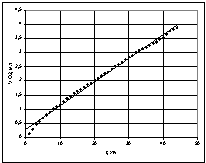
Графік
залежності об'єму поглиненого кисню від часу в інтервалі температур має вигляд:
(рис. 7).
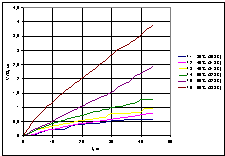
Рис.
7 – Графік залежності об'єму поглиненого кисню від часу при різних температурах
(інтервал температур 35 – 60 °С)
Залежність
швидкості окислення кумолу від температури в присутності ініціатора
представлено на рис. 8.

Рис.
8 – Графік залежності швидкості окислення від температури
Аналізуючи
отримані експериментальним шляхом дані, можна зробити висновок, що найбільша
швидкість окислення кумолу в присутності ініціатора окислення (N-гідроксифталіміду)
спостерігалася при температурі 60 °С (333 К). Зі зниженням температури процесу
на 5 °С швидкість окислення падає в 1,5 рази, при зниженні на 10 °С – в 3 рази.
Порівняльна характеристика складу продуктів
розкладання гідропероксида кумолу, що надходять в атмосферу, при температурі 60°С та 110°С показана на рис. 9
(у мол. %).
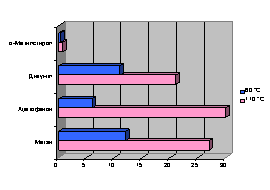
Рис. 9 – Склад продуктів розкладання гідропероксиду
кумолу при температурах відповідно 60 °С та 110 °С
Отримані дані дозволяють говорити
про те, що найвища швидкість окислення кумолу
спостерігалася при температурі 60 °C. При цьому, знижуючи температуру процесу
окислення кумолу в 2 рази ми можемо домогтися зменшення
кількості шкідливих речовин, що утворюються в
процесі та надходять в атмосферу: ацетофенону
– в 5 разів; дикумілу – в 1,9 раз; метану – в 2,25 раз. Таким чином, можна говорити про підвищення рівня екологічної безпеки виробництва фенолу і
ацетону.
Література:
1.
Лебедев
Н.Н. Химия и технология основного органического и нефтехимического синтеза.
/ Н.Н. Лебедев. – М. : Химия, 1989. – 608 с.
2.
Кружалов Б.Д. Совместное
получение фенола и ацетона. / Б.Д. Кружалов, Б.Н. Голованенко. – M. : Химия, 1983. – 200 с.
3.
Харлампович Г.Д. Фенолы. / Г.Д. Харлампович, Ю.В. Чуркин – М. : Химия,
1986. – 375 с.
4.
Андреас Ф. Химия и
технология пропилена. / Ф. Андреас, К.
Гребе – Л. : Химия, 1973. – 368 с.