Павлов А. М.
Восточно
– Казахстанский университет им. Аманжолова.
Усть
– Каменогорск. Казахстан.
ОПРЕДЕЛЕНИЕ СРЕДНЕГО РАССТОЯНИЯ МЕЖДУ МОЛЕКУЛАМИ
В КЛАСТЕРЕ С
ПОМОЩЬЮ ТЕОРЕМЫ ВИРИАЛА.
До сих пор теорема вириала использовалась для получения уравнения состояния
газов. Однако с помощью этой теоремы можно определить среднее расстояние между
молекулами в димере и в более крупном
кластере, а также плотность конденсированного состояния вещества.
Как известно, теорема вириала гласит:
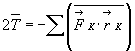 (1)
(1)
и для потенциальных сил
![]() , (2)
, (2)
где ![]() -средняя кинетическая
энергия,U-потенциальная энергия.
-средняя кинетическая
энергия,U-потенциальная энергия.
Правая часть равенств (1) и (2) называют вириалом, а сами эти равенства
выражают теорему вириала.
Рассмотрим несколько примеров
использования этой теоремы:
а)
Ньютоновское взаимодействие. В этом случае
![]()
и значит
![]()
Следовательно,
![]()
Полная
энергия системы равна
![]()
При ![]() будет и
будет и ![]() . Это условие
финитного движения. Из связи
. Это условие
финитного движения. Из связи ![]() и
и ![]() можно найти первую
космическую скорость:
можно найти первую
космическую скорость:
![]() и
и ![]() .
.
б) Взаимодействие, описываемое потенциалом
Леннарда-Джонса (6 –12):
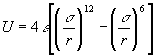 .
.
Теперь
 .
.
Значит
![]() ,
,
где
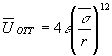 и
и 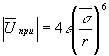 .
.
Полная потенциальная энергия равна
![]() ,
,
а полная энергия системы будет
![]() . (3)
. (3)
Для образования простейшего кластера – димера необходимо, чтобы было ![]() . Тогда оказывается,
что
. Тогда оказывается,
что
![]() (4)
(4)
Подставив сюда значения ![]() и
и ![]() , получаем
, получаем
![]() ,
,
где
![]() - диаметр молекулы. Напомним, что равновесное
расстояние, при котором
- диаметр молекулы. Напомним, что равновесное
расстояние, при котором ![]() , равно
, равно ![]() .
.
При ![]()
![]() . Чтобы было
. Чтобы было ![]() необходимо, чтобы
необходимо, чтобы ![]() было меньше
указанного значения. Средняя потенциальная энергия при
было меньше
указанного значения. Средняя потенциальная энергия при ![]() равна
равна ![]() . Эту величину можно было бы считать энергией связи
системы, если бы кинетическая энергия
равнялась нулю. Но кинетическая энергия равна
. Эту величину можно было бы считать энергией связи
системы, если бы кинетическая энергия
равнялась нулю. Но кинетическая энергия равна ![]() и
и ![]() .
.
Напомним, что здесь речь идет о средней энергии относительного движения.
Центр масс системы может иметь определенную скорость и в лабораторной системе отсчета ![]() .
.
Если среднее расстояние между молекулами известно, то зная ![]() , можно рассчитать плотность вещества, состоящего из данных частиц. В самом деле, если между частицами расстояние
, можно рассчитать плотность вещества, состоящего из данных частиц. В самом деле, если между частицами расстояние ![]() , то размер шара,
занимаемого одной молекулой, будет
, то размер шара,
занимаемого одной молекулой, будет ![]() и объем,
приходящийся на один киломоль таких частиц, будет
и объем,
приходящийся на один киломоль таких частиц, будет
![]() .
.
Тогда плотность вещества равна
![]() . (5)
. (5)
Например, у молекулы азота ![]() . Тогда
. Тогда ![]() и, так как
и, так как ![]() ,
, ![]() . Плотность твердого
азота составляет
. Плотность твердого
азота составляет ![]() , а жидкого -
, а жидкого - ![]() . Погрешность
определения плотности твердого азота
составляет 8%. Примерно с такой же погрешностью определяется диаметр молекул
. Погрешность
определения плотности твердого азота
составляет 8%. Примерно с такой же погрешностью определяется диаметр молекул ![]() .
.
Ещё один пример. Диаметр молекулы
кислорода ![]() и
и ![]() ,
, ![]() . Тогда из (5)
следует, что плотность
конденсированного кислорода должна быть
. Тогда из (5)
следует, что плотность
конденсированного кислорода должна быть ![]() . Однако плотность твердого кислорода составляет
. Однако плотность твердого кислорода составляет ![]() , а жидкого -
, а жидкого - ![]() . Снова плотность той
и другой фазы меньше. Однако разброс в
значениях
. Снова плотность той
и другой фазы меньше. Однако разброс в
значениях ![]() достаточно большой:
от
достаточно большой:
от ![]() до
до ![]() . Если взять
последнее значение
. Если взять
последнее значение ![]() , то будет
, то будет ![]() .
.
Таким образом, можно констатировать, что с
помощью теоремы вириала можно
определять средние расстояния между частицами в твердой фазе и плотность этой
фазы. Однако, необходимо отметить: поскольку расчетное значение плотности твердого тела получается
почти всегда больше табличной, то в
твердом теле нет плотной упаковки
частиц. Об этом же говорит наличие диффузии в твердых телах.
Поскольку разность между плотностью жидкой
фазы и рассчитанной по (5) ещё больше,
то в жидкости упаковка молекул ещё реже.
Промежутки между молекулами и микрополости занимают достаточно большой
объем. Так в азоте этот объём составляет порядка ![]() в
в ![]() , а в кислороде -
, а в кислороде - ![]() в 1 куб. метре.
в 1 куб. метре.
Литература.
1.
Цянь Сюэ – Сень.
Физическая механика. – М.: Мир. – 1965 стр 316.
2.
Енохин А. С. Справочник
по физике и технике. – М.: Просвещение,
1989, - 224 с.
3.
Голдстейн Г. Классическая механика.-М.; Наука,-415 с.