Секция Микробиология
1Канаева
З.К. – х.ғ.к., доцент, 2Түлкібай
А.Е. – магистрант
1Биология және Биотехнология
мәселелері Ғылыми зерттеу институты, әл-Фараби атындағы
ҚазҰУ, 2Қ.И.Сәтбаев
атындағы Қазақ ұлттық техникалық
университет, і Алматы, Казахстан
Еківалентті темірдің
және элементті күкірттің тотығуына натрий хлоридінің
концентрациясының әсері
Жер астын бактериалдық шаймалау әдісі химиялық шаймалау әдісіне қарағанда ерекшеленеді,
өйткені шаймалайтын ерітінділер мен
рудалық материал шаймалау процесін интенсифтендіретін
микроорганизмдерден тұрады. Сондықтан да микроорганизмдердің
негізгі ролі мен элементтік күкіртті, сульфидтік минералдарды
тотықтандырудан тұрады. Сульфидтік минералды және
күкіртті, еківалентті темірді тотықтандыру кезінде Thіobacіllus, Leptospіrіllum, Sulfolobus,
Sulfobacіllus және Acіdіanus
бактериялары да қатысады [1].
Темір – Thіobacіllus ferrooxіdans және басқа бактериялары
үшін тез тотықтанатын субстракт болып табылады. Тотығу
реакциясы мына схема бойынша жүреді:
4Fe2++O2+4H++бактериялар « 4Fe3++2H2O
△G=38 кДж/моль.
Т.ferrooxіdans микроорганизмінің ерекше
қабілеті бар – ол қышқылдық орта жағдайында
темірді тотықтырып тотыққа айналдырады.
Химиялық бақылау кезеңіне қарағанда жай кездері темірдің бактериалдық тотықтануы 200-500 мың есе жоғары [2].
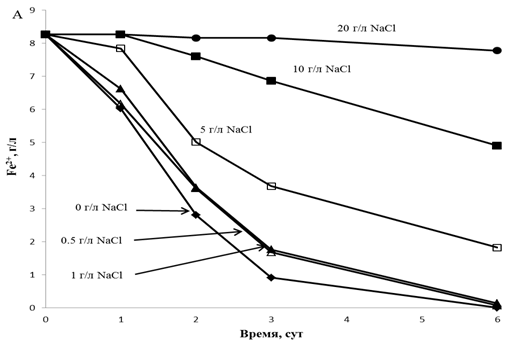
Зерттеліп отырған A. ferrooxidans штаммының қатысуында еківалентті темірдің тотығуына ортадағы NaCl концентрациясының әсері 1(А,Б)- суретте көрсетілген. Екі штаммен де темірдің тотығуын NaCl тежейтіндігін келтірілген мәліметтер көрсетеді. Екі жағдайда да 0,5 г/л және 1 г/л концентрациясы темірдің тотығуын сәл ғана ингибирлейді. TF1 Штаммы NaCl 5 г/л концентрациясында 1 тәулік лаг-фазадан кейін темірді белсенді тотықтыра бастайды, ал тотығу жылдамдығы NaCl аз концентрациясына қарағанда айтарлықтай төмен болды (алты күннен кейін тотығу NaCl 0,5 г/л және 1 г/л концентрациясындағы ортада еківалентті темір концентрациясының іздері ғана қалды, ал 6 тәу 5 г/л NaCl концентрациясында - 1,8 г/л Fe2+). 10 г/л NaCl концентрациясында темірдің тотығу жылдамдығы тіпті төмен болды (6 тәулік тотығудан кейін қоректік ортада 5 г/л Fe2+ қалып отырды). 20 г/л NaCl концентрациясында темір аз жылдамдықпен тотығады (6 тәулікте шамамен 0,5 г/л).
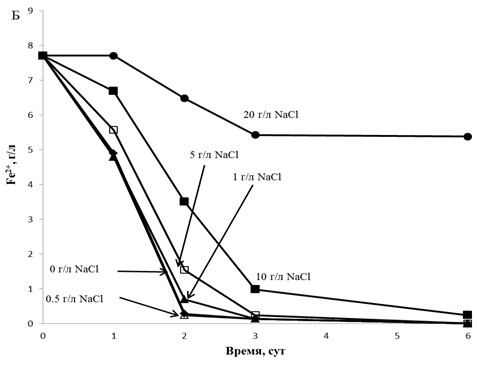
TF2 штаммымен темірдің тотығуын NaCl аз
дәрежеде тежейді. 5 г/л NaCl концентрациясында темірдің
тотығу жылдамдығы NaCl аз концентрациясына қарағанда шамалы
төмен болды (3 тәулік тотығудан кейін 0, 0.5, 1
және 5 г/л NaCl концентрациясында ортада еківалентті темір концентрациясының іздері қалды). 10 г/л
NaCl концентрациясында
темірдің тотығу жылдамдығы NaCl аз концентрациясына
қарағанда айтарлықтай төмен болды, бірақ
бәрібір жеткілікті
жоғары (3 тәулік тотығудан кейін ортада шамамен 5 г/л Fe2+ қалды). 20 г/л NaCl концентрациясында темір аз
жылдамдықпен тотығады, бірақ TF1 штаммына
қарағанда әлдеқайда жылдам (6 тәулікте шамамен 2,0 г/л
тотығады )
(1(Б)- сурет).
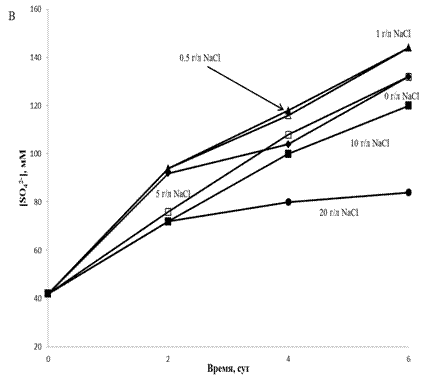
Зерттеліп отырған A. ferrooxidans штаммының қатысуында күкірттің тотығуына
ортадағы NaCl концентрациясының әсері 2(В,Г)-
суретте көрсетілген. Екі штаммен де күкірттің тотығуын NaCl
жоғары концентрациясында (10-20 г/л) тежейтіндігін келтірілген мәліметтер
көрсетеді. Ортада NaCl қатыспаған жағдайына
қарағанда, екі жағдайда да 0,5 г/л және 1 г/л
концентрациясы күкірттің
тотығуын өте
жоғары жылдамдықпен өткізді. TF1 штаммымен күкірттің
тотығуы 20 г/л NaCl концентрациясында айтарлықтай ғана
тежелді (тотығу жылдамдығы NaCl аз концентрациясына
қарағанда әлдеқайда төмен болды, бірақ тотығу
толық ингибирленбеді – 6 тәулікте
сульфат концентрациясы 40 мМ-ден 80 мМ дейін
өсті)
|
|
|
1(А,Б) - сурет.
TF1 және TF2 A.
ferrooxidans
штаммдарының қатысуында еківалентті темірдің тотығуына NaCl
әртүрлі концентрациясының әсері А – TF1 штаммның қатысуында еківалентті темір концентрациясының
тотығу процесінің нәтижесінде өзгеруі; Б– TF2 штаммның қатысуында еківалентті темір концентрациясының тотығу процесінің нәтижесінде өзгеруі. |
|
|
|
|
|
2(В,Г)- сурет. TF1 және TF2 A.
ferrooxidans
штаммдарының қатысуында элементті күкірттің тотығуына NaCl
әртүрлі концентрациясының әсері В – TF1 штаммның қатысуында күкірттің
тотығу процесінің нәтижесінде сульфат концентрациясының
өзгеруі; Г
– TF2 штаммның қатысуында күкірттің
тотығу процесінің нәтижесінде сульфат концентрациясының
өзгеруі. |
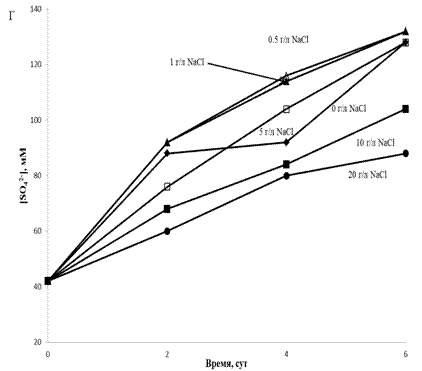
10 г/л NaCl концентрациясында күкірттің
тотығу жылдамдығы 5 г/л қарағанда NaCl аз
концентрациясына қарағанда айтарлықтай төмен болды.
TF2 штаммымен күкірттің
тотығуы NaCl көп дәрежеде ингибирленген болатын. NaCl төмен концентрациясына
қарағанда 10 г/л NaCl концентрациясының тотығу
жылдамдығы әлдеқайда төмен болды (6 тәулік тотығудан кейін 0 және 5 г/л
NaCl
концентрациясында ортада шамамен 130 мМ
сульфат болды,
ал 10 г/л концентрацияда – шамамен 100 мМ). TF2 штаммымен күкірттің
тотығуы 20 г/л NaCl концентрациясында айтарлықтай тежелді,
бірақ TF1 штаммының жағдайы сияқты толық
ингибирленген жоқ, 6 тәулікте сульфат
концентрациясы 40 мМ-ден 80 мМ-ге дейін өсті.
Сонымен, штаммдармен күкірттің тотығуы еківалентті темірдің тотығуына қарағанда натрий хлоридімен аз дәрежеде ингибирленгенін айтуға болады. А. ferrooxidans штаммымен темірдің тотығуы күкірттің тотығуына қарағанда хлоридтің өте төмен концентрациясында тежеледі, бұл бұрын алынған деректерге [3] сәйкес келеді. Бұрын зерттелген түрлердің кейбір өкілдеріне қарағанда [4] зерттелген штаммдар NaCl біршама өте төзімді екенін жалпы алғанда, алынған мәліметтер көрсетеді.
Әдебиеттер тізімі:
1. Каравайко Г.И., Дубинина Г.А., Кондратьева Т.Ф. Литотрофные микроорганизмы окислительных циклов серы и железа // Микробиология. 2006. Т. 75. № 5. С. 593–629.
2. Канаев А.Т. Интенсификация процесса извлечения урана биотехнологическим способом из бедных руд // Монография, –Алматы, 2010. –143 с.
3 . Harahuc L., Lizama H.M., Suzuki
I.Selective Inhibition of the Oxidation of Ferrous Ironor Sulfur in Thiobacillusferrooxidans
// Applied and environmental microbiology. 2000. V. 66. P. 1031–1037.
4. Zammit C.M., Mangold S., Jonna
V., Mutch L.A., Watling H.R., Dopson M., Watkin E.L. Bioleaching in
brackish waters – effect of chloride ions on the acidophile population and
proteomes of model species // Appl MicrobiolBiotechnol. 2012. V. 93. P.
319–329.